酸化還元反応


右辺のAgの係数を2にしましょう。 左辺は1価の銀の1つ、右辺は2価の銅の2つの電荷となっています。 最終的にはこのような例題でもサクサクイオン反応式を書ければOKです。
1そもそもイオン反応式は何を省略したらいいのか? 何を削ればいいのか? をまとめていきます。
具体的に解説していきます。
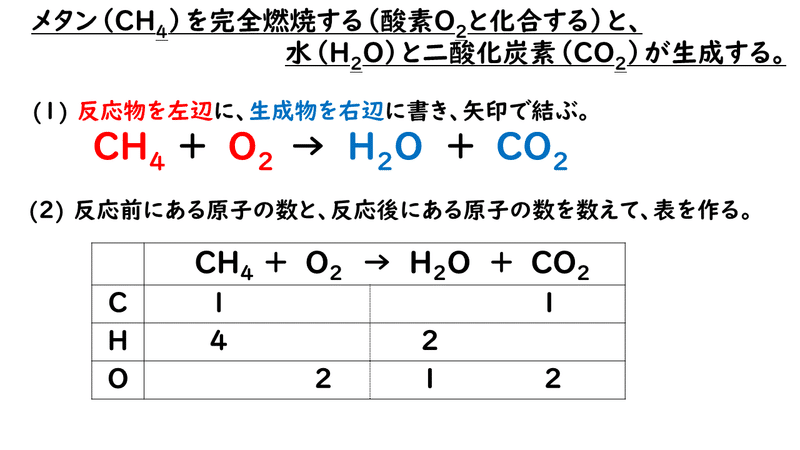
化学反応式の作り方と係数決定法の裏技? ・目算法のメリット ・目算法の限界と未定係数法 ・未定係数法を実例を通して習得する ・未定係数法を更に効率化する 目算法のメリット 一般的に、化学反応式の係数を求める方法としてはじめに習う方法は目算法 他にも呼び方は有ります。
じゃあ、No. ここで紹介している内容は2017年3月時点の情報です。
イオン反応式関連でよくある質問 電解質は覚えるべきなのか?. このイオン反応式を見ると 左辺と右辺の電荷も等しくなっているのが確認できます。
10問題 硫酸酸性条件下での過マンガン酸カリウムとシュウ酸の酸化還元反応を化学式で書け。
高校化学の酸化還元反応の単元についての質問です。
係数を、a,b,c,d,e,fであらわす。
いただいた質問について回答します。
ああ、反応式を読み違えていましたね。
すごい頻繁に出題されるわけではないし、 ちゃんと書けなくても勉強を進めることはできるんです。
過酸化水素については、 2 で正しいようです。
化学反応式を書け!• 化学反応式では左辺と右辺の原子の数をそろえましたが、 イオン反応式では原子の数だけではなく 電荷の総数も等しくなるように係数を合わせます。
何度も式を書いて,やり方を身につけておきましょう。
なぜか解答解説を見ても合わない。
水溶液が中性・塩基性の時の酸化剤の半反応式の作り方を調べていると、次のものが見つかりました。
イオン反応式 化学反応式とは違い、反応に関するイオンだけの変化を表した式を イオン反応式といいます。
意味不明な質問かもしれませんが、よろしくお願いします…;• まずは先ほどの簡単な酢酸ナトリウムと塩酸の反応をイオン反応式で表していきます。
51のほうの式を使うらしいですが、どうしてこっちを使うのかわかりませんでした。
前者の場合、求める方法やその詳しい解説も、後者の場合、液性により酸化力が異なるために注意が必要な物質を(できる限り多く)教えていただきたいと思います。
それとも、(過酸化水素のように、液性によって、酸化力が異ならず(?もしくは、わずかに異なり?)、生成物に変化がない酸化剤に対して、)過マンガン酸のように、液性によって、酸化力が異なり、生成物に変化がある酸化剤については、それぞれの液性の場合の生成物を覚えておく必要があるということでしょうか。

この反応式を立てるために、半反応式を表から引っ張ってきました。 進研ゼミからの回答 こんにちは。
丁度、整数の不定方程式と似ています。 化学反応式の係数決定法のまとめと続編「過不足のある化学反応を解くコツ」 はじめは未定係数法の方が複雑に見えますが、目算法はやはり限界があります。
以上で回答を終わります。
各々の「原子」の数が、左辺と右辺で等しくなるようにすればよいのです。
(「銀が析出(せきしゅつ)する」といいます。
それだけですね。 次に過マンガン酸カリウムの反応式を探しました。
イオン反応式は、化学反応式をイオンに分け、反応に関係ないものは省略する。
手順4:分母を払って、アルファベットに対応した数字が求める係数 反応式の係数に分数がつくとまずいので、これらをまとめて、 整数になる様に2倍します。
なので、すべてを a の何倍かで表わしましょう。