有機反応機構(カルボン酸とその誘導体の反応)

実際に、アミド結合の炭素 - 窒素結合の長さは 0. 求核的アシル置換反応では、脱離基 L の性質が、反応段階の速度に影響を及ぼします。 とどまることを知らない新型コロナのせいで、今年こそは「オンサイト…• 脱離基の選び方に関して、もう一度最初のエステルのけん化の例に戻りましょう。 調製と性質 [ ] 他のアルコキシドと同様、に金属を加えると生じる。
3

実際に、アミド結合の炭素 - 窒素結合の長さは 0. 求核的アシル置換反応では、脱離基 L の性質が、反応段階の速度に影響を及ぼします。 とどまることを知らない新型コロナのせいで、今年こそは「オンサイト…• 脱離基の選び方に関して、もう一度最初のエステルのけん化の例に戻りましょう。 調製と性質 [ ] 他のアルコキシドと同様、に金属を加えると生じる。
3リン系[フォスファゼン塩基](BEMP,グアニジノホスファゼン,P2塩基,P5塩基,) アルコキシドは極性有機溶媒には溶けやすいです。 水酸化物塩(水酸化ナトリウム、水酸化カリウム、水酸化タリウム)• この反応は水素と熱を発生しますので,水素が空中の酸素と激しく反応します。
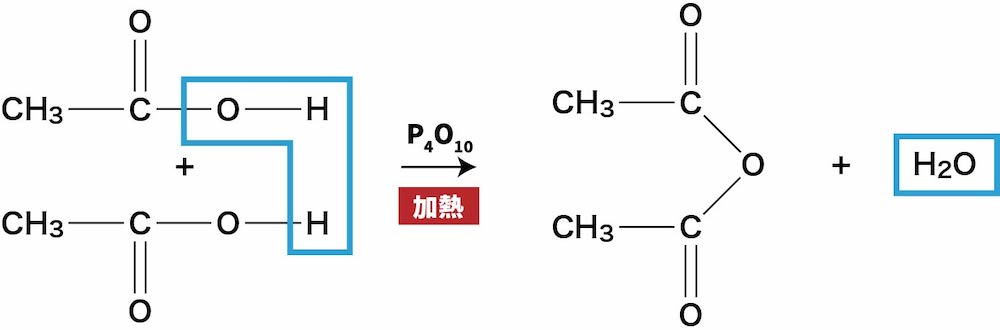
16 無水酢酸 CH 3 CO 2 O の代表的な求核的アシル置換反応 無水酢酸 CH 3 CO 2 O を加水分解すると、カルボン酸である酢酸 CH 3 COOH に戻ります。
したがって、この反応機構は次の図に示すように表すことができます。
第一回• アランは加水分解により 水酸化アルミニウムとなる。


本連載も3回目に突入しました。 炭酸塩 炭酸セシウム)• 4 M、45 ml、109 mmol。 金属ナトリウム、カリウム などです。
2反応の第一段階は、アルデヒドやケトンの反応と同じく、カルボン酸のカルボニル酸素のプロトン化です。 水に触れるとを受け、 tert-ブチルアルコールとに変わる。
この酸塩基平衡は、可逆的で速く、酸素を含む化合物の酸性溶液中では、常に起こる平衡です。
これがプロトン付加されることで、目的の アミンが生成する。
フィッシャーのエステル化反応は、非常に有名な反応ですが、この反応は平衡反応であるために、反応原料のどちらか 1 つを、通常大過剰に用いる必要があったことを思い出して下さい。
塩基はアニオンが多いと言いましたが、アルコールのようなプロトンを持つ溶媒を使ってしまうとアルコールのプロトンを奪ってしまう反応が起こるのはもちろんのこと、アルコールの水素はプラスに分極しているので、マイナスの塩基と水素結合して安定化(溶媒和)するので塩基性が低下してしまいます。 金属ナトリウムなど、プロトンよりも酸化還元電位がかなり高い金属の場合、アルコールに金属が溶ける際にガスを放出して金属アルコキシドが生じる。 実はこの反応では、求核剤としてカルボニル基を攻撃した水酸化物イオンも脱離する可能性があるのです。
15したがって、この反応は特に、「求核的アシル置換反応 nucleophilic acyl substitution 」と呼ばれています。
関連化合物 [ ] tert-ブトキシド同様に求核性が低く、さらに強い塩基として、や、などのが用いられる。
例えば、アルコールかカルボン酸のいずれか値段の安い方を大過剰に用いるとか、生成するエステルや水 H 2 O を蒸留などにより反応系から取り除けば、ル・シャトリエの法則により、反応は右側へ進行します。
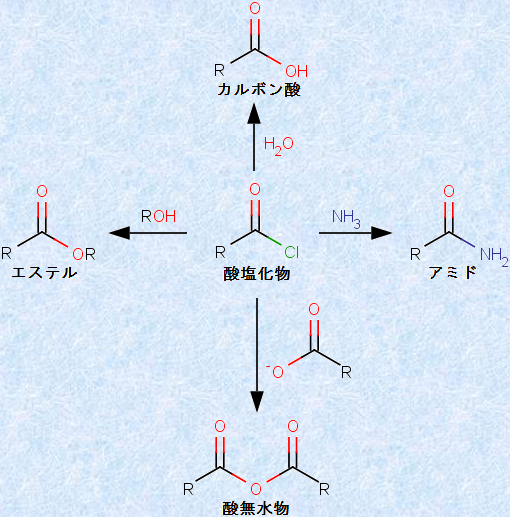
11 酸塩化物を用いたアシル化合物の合成 ハロゲン化アシルは、ほとんどの求核剤と速やかに反応します。

フィッシャーのエステル化反応を考えてみると、生成物の水分子が、「酸の OH とアルコールの H から生成するのか」それとも「酸の H とアルコールの OH から生成するのか」という、反応機構上の疑問が浮かんできます。 7 水分子の脱離 第五段階 反応の第六段階では、脱プロトンによってエステルが生成し、酸触媒が再生します。 水酸化物塩 水酸化ナトリウム、水酸化カリウム、水酸化タリウム、水酸化リチウム)• アルドール反応では、塩基が触媒量で良かったのに、クライゼン縮合では、塩基が化学量論量必要である理由をしっかり把握して下さい。
4関連反応• 既存のリチウムイオン電池は可燃性・自己燃焼性の有機溶媒を用いているために安全性に対する致命的な不安を抱えている。 脱離したアルコキシドイオンは、Liイオンと塩を形成する(カルボン酸が出発物質の場合は、水酸化物イオンが脱離して水酸化リチウムとなる)。
5 アルコール分子の求核付加 第二段階 反応の第三段階および第四段階は、ルイス塩基性の酸素にプロトンが付加したり、脱離したりする平衡反応です。
1 カルボン酸とその誘導体の一般的な構造式 これらの分子は、構造的に似ているだけでなく、化学反応も密接に関連しており、あるアシル化合物の反応は、一般的に他のアシル化合物の合成に相当します。
まず、水酸化物イオンがカルボニル炭素を攻撃する。


ただし、これらの反応はすべて平衡反応であり、基本的には、エステルからカルボン酸に戻る加水分解反応も、並行して存在していることに注意が必要です。 なお では付加脱離機構を右のように省略して描いている場合があります。 販売会社、時期、グレードなどによって価格は異なります。
9Williamsonエーテル合成の副反応 第二級、第三級アルキルハライドは脱離反応が起こりやすいので注意しましょう。
は最も強力な塩基の1つです。
1 の左側には、求核剤に対する反応性の減少順に、 4 つのアシル化合物が示されています。
例えば、アセトアミドは、次の図. こめやん アルカリ金属のアルコキシドは塩基性が高いため、プロトンを引き抜く力が強いので、第二級や第三級の求電子剤の場合は求核置換によるエーテル生成の他に脱離反応によるアルケンの生成も起こりやすいです。

19 アセトアミドの加水分解 求核的アシル置換反応のまとめ 求核的アシル置換反応は、次の表. タンパク質におけるアミド結合は、特に「ペプチド結合 peptide bond 」と呼ばれています。 しかし、 OR の構造が同じである限り、塩基触媒によるエステル交換反応が起こっても、生成物は出発物質と同じになり、見かけ上は何の変化も起こりません。 を加えた付加体はシュロッサー塩基 Schlosser base と呼ばれ、例えばのからプロトンを引き抜くなどの非常に強い塩基性を示し、超塩基 superbase のひとつとされる。
11続いてニトロ基から電子が押し戻されて、塩化物イオンが脱離し、芳香族環が再生されます。 この一連の電子の流れのなかの要点を言うと、 求核剤がカルボニル基を 叩いて 、酸素アニオンが脱離基を 押し返す という部分です。
しかし、最終的に酸塩基反応が起こると、反応の触媒は消費されてしまいます。
塩基としての利用もありますが、吸湿性が小さめなフッ化物イオン源として利用されています。
アルカリ土類水素化物 アルカリ土類金属の水素化物水酸化物、炭酸塩はアルカリ金属のそれと比べると利用例は少ないです。