アダリムマブバイオシミラー市場の機会2021_27ファイザー、サムスンバイオシミラー、サンド
ジーンテクノサイエンスはさらに、同アフリベルセプト(アイリーア)も前臨床段階で開発中です。
19This therapy will offer a new lease of life to millions in India who have not had access to this therapy so far. 【本件特許の分割ファミリー特許】• アダリムマブBS皮下注40mgシリンジ0. 「アダリムマブBS」はヒュミラよりお安い! 「アダリムマブBS」の魅力はなんといっても、ヒュミラよりお値段が安い事。 マイランEPD合同会社• 診療報酬改定で、人工腎臓(透析)の包括点数が引き下げられたことから、価格の低いバイオシミラーへの切り替えが進みました。
この画期的進展についてザイダス・カディラの副マネジングディレクターであるシャルビル・P・パテル博士は「イノベーションは満たされていない健康管理の必要を埋めなければならず、特に慢性症状の病気、障害に苦しんでいる患者にソリューションを提供しなければならないとザイダスは信じている。
特許5612305: 無効審判は請求されていない。
またバイオ製剤は高い有効性と安全性が得られることが関節リウマチ以外の多くの疾患でも確認され、近年急速に使用が増加しており、新薬にしめるバイオ製剤の割合は年々増加しています。


抗アダリムマブ抗体 AAA とは 抗アダリムマブ抗体(anti-adalimumab antibody:AAA)は、アダリムマブ ヒュミラ に対する中和抗体であり、血清アダリムマブ濃度を低下させるため、薬剤の有効性を減弱させる可能性があります。 AVT02により、Alvotechはバイオシミラーの競合他社との差別化を図ることができる立場にある。
4平素は格別のお引き立てを賜りたく、厚く御礼申し上げます。 AbbVie社の2019 Annual Report()によると、AbbVie社はいくつかのバイオシミラー会社と特許係争の和解・ライセンス契約を締結しており、その契約の下、そのライセンスが欧州では2018年に、また米国では2023年に始まるとしています。
バイオシミラー開発には多額の投資を要するだけに、協和発酵キリンの決断は各社のバイオシミラー事業にも大きな影響を与えそうです。
In the United States, non-composition of matter patents covering adalimumab expire no earlier than 2022. マイラン製薬株式会社 の4社が統合して、ヴィアトリスグループとして協働していくようです。
バイオシミラーについて バイオ医薬品とは バイオ医薬品は、生体による生合成過程を利用して製造され、ホルモン製剤や抗体製剤といった分子量が非常に大きく複雑な構造を持ちます。


協和発酵キリンは今年1月に公表した中期経営計画で、2019年に特許切れを迎える腎性貧血治療薬「ネスプ」(ダルベポエチンアルファ)のオーソライズド・ジェネリックの開発を検討する方針を表明。 臨床現場での評価を高めることが普及に向けた最大のカギで、同等性への懸念を払拭するためのエビデンス構築や情報提供活動は欠かせません。
バイオ後続品(バイオシミラー)とは、既に発売しているバイオ医薬品(先行バイオ医薬品)と品質や有効性、安全性が同等・同質 *と認められたバイオ医薬品です。
Biosimilars are follow-on versions of biopharmaceuticals. 2017〜2021年の歴史的期間および2021年から2027年までのアダリムマブバイオシミラー予測期間の世界的な に関する最新のレポート調査によると、技術の進歩とさまざまな手術の増加は、予測期間を通じて世界のアダリムマブバイオシミラー市場の主要な推進力になると予測されています。
We are also enthusiastic about the Phase I pharmacokinetic study AVT02-GL-101 in healthy volunteers that is ongoing in Australia and New Zealand. 以下の延長登録出願がされていることから、本件特許は「プレベナー13水性懸濁注」に関するものであると考えられる。
ただし、市場の競争力のある性質は、世界的なアダリムマブバイオシミラー市場に参入する意欲のある新しいプレーヤーにとって強力な課題をもたらします。

インフリキシマブ(レミケード) インフリキシマブのバイオシミラーは、日本化薬が国内初の抗体医薬のバイオシミラーとして14年11月に発売。 日本においては、2008年4月に関節リウマチ(既存治療効果不十分な場合に限る)を効能・効果として承認されて以降、尋常性乾癬、関節症性乾癬、強直性脊椎炎、クローン病、若年性特発性関節炎等に関する効能・効果で承認されています。 高額療養費制度があるとはいうものの、1ヵ月28,000円から45,000円の自己負担金の増加は非常に大きく、患者さんの経済的負担を増しています。
3I am an in-house patent attorney for a pharmaceutical company in Japan. 市場に参入することが期待されるさまざまなプレーヤーの増加は、今後数年以内に主要なプレーヤー間の競争を後押しするために計算できるもう1つの大きな問題です。
JCRと三和化学の製品は同年11月に、マイランの製品は同年12月に発売されました(JCRの製品は提携先のキッセイ薬品工業が販売)。
11月の薬価収載が見込まれます。
Speaking on the breakthrough, Deputy Managing Director of Zydus Cadila, Dr. The European Medicines Agency EMA : 欧州での基本特許はSPC含めて2018年10月15日に満了しました。

It is estimated that more than 12 million patients in India suffer from these chronic conditions which progressively deteriorate and lead to lifelong pain and in some cases, even disability. トラスツズマブ(ハーセプチン) トラスツズマブのバイオシミラーは、18年8月に日本化薬とセルトリオンが発売。 With AVT02, Alvotech is well positioned to differentiate from biosimilars competitors. 具体的には、他抗体製剤を使用し、寛解や副作用等により中断後、再開する際などに体内で「中和抗体」ができ、再開時に十分な薬効が得られないことが少なからずあります。
ロバート・ウェスマン創業者兼会長は「集中的な準備を経て、当社初のバイオシミラー製品が最初の患者を登録できたことは喜ばしい。
[Online] Available at: [Accessed: Mar 2019]. 本試験では、欧州の約30施設で400人の参加者が登録される予定。
Patel said, "At Zydus, we believe that innovations must bridge unmet healthcare needs and provide solutions to patients who are suffering from disease and disability especially in such chronic conditions. Zydus Cadila becomes the first company anywhere in the world to launch the biosimilar of Adalimumab - the world's largest selling therapy. 「アダリムマブBS」はヒュミラよりお安い! 現在ヒュミラで治療されているリウマチや乾癬性関節炎の方がアダリムマブBSに切り替えると、ざっくり月にお薬代が1万3千円以上も安くなります。
日本化薬は16年度、インフリキシマブの売上目標を41億円に設定。

協和キリン富士フイルムバイオロジクスのによると、本剤は2019年に世界で268. The objective of the study is to compare AVT02 and HUMIRA R in terms of safety, efficacy, tolerability and immunogenicity in adult patients with moderate to severe chronic plaque psoriasis. 第一三共はアムジェンとの提携にアダリムマブを含めていますが、開発段階は不明。
1持田製薬も幅広いアライアンスでパイプラインを拡充させています。 TNF阻害薬として、このアダリムマブ〈ヒュミラ皮下注〉は「レミケード」、「エンブレル」に次いで3剤目の生物学的製剤となります。
今まで飲み薬などジェネリック医薬品が作られているようなお薬は、化学合成で作られる分子量が小さい医薬品が中心でした。
表は先行バイオ製剤とその薬価 2012年 と一日当たりの薬剤費をまとめたものです。
親市場内の一般的な傾向、マクロおよびミクロ経済指標、規則および義務の個別の分析は、調査の範囲の下に含まれています。

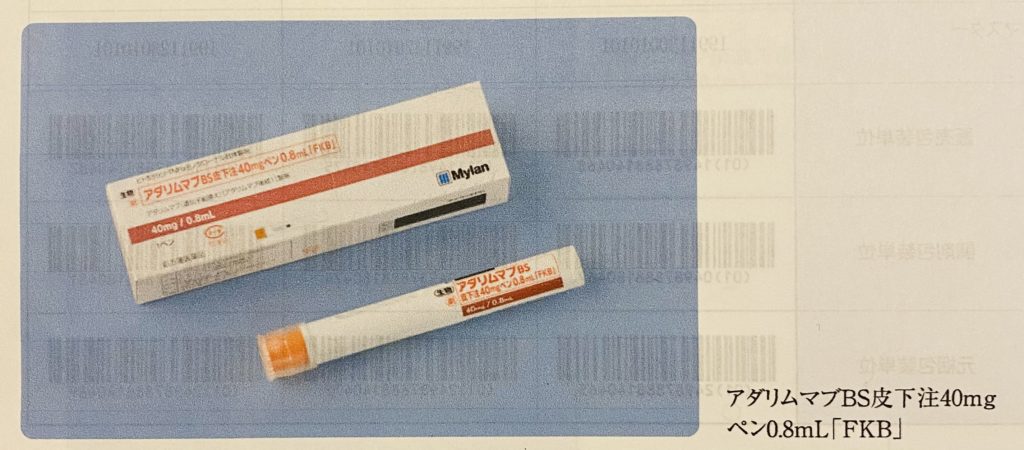
アダリムマブBS皮下注「FKB」の国内製造販売承認取得! 協和キリン富士フィルムバイオロジクスさんからいただいた国内製造販売承認取得のお知らせがコチラ! アダリムマブBS皮下注「FKB」 アダリムマブ(遺伝子組換え)[アダリムマブ後続1]製剤 40mgシリンジ0. 延長登録出願はされていない。 アダリムマブBS皮下注「FKB」 ヒュミラ皮下注のバイオシミラー(BS)は、 協和キリン富士フイルムバイオロジクスさんが1番手となり製造販売承認が得られたようです。
14協和キリン富士フイルムのほかには、持田製薬やジーンテクノサイエンス、第一三共が開発を進めています。
エタネルセプト(エンブレル) エタネルセプトのバイオシミラーは、持田製薬が18年1月に承認を取得し、5月に提携先のあゆみ製薬から発売されました。
カテゴリー タグ. アダリムマブのバイオシミラー市場レポートを参照して理解を深める: グローバルなアダリムマブバイオシミラー市場レポートは、集中的な一次分析(経験豊富なアナリストのインタビュー、調査、観察による)とアダリムマブバイオシミラー市場の二次分析(推定可能な有料ソース、業界誌、業界団体データベースを伴う)によってまとめられています。
地域の観点から、市場は予測期間を通じて市場の巨大なシェアを持つ世界的なアダリムマブバイオシミラー市場を操縦すると予測されます。


しかし、インドの患者はこの治療薬を利用できなかった。
というか、80mg製剤の販売は今のところ、ないみたいです。
ザイダス・カディラ(Zydus Cadila)は世界で最も多く売れている治療薬、アダリムマブ(Adalimumab)のバイオシミラーを発売する世界初の企業になる。
03(延長含む) 参加人: 日医工、共和薬品 別件無効2020-800076号事件(請求人: 日医工)は、本件(無効2020-800034)を先に審理することとしたため手続中止。
ダルベポエチンアルファのバイオシミラーは、キッセイ薬品工業とJCRファーマの共同開発品はP3試験に入っており、三和化学研究所や富士製薬工業、日医工も候補品を導入するなどして開発を進めています。

これらの生物製剤は関節炎、がん、不妊、脳卒中などの自己免疫障害の治療を目的として開発中である。 われわれはまた、オーストラリアとニュージーランドで進行中の健康なボランティアを対象とした第I相薬物動態試験(AVT02-GL-101)にも熱心に取り組んでいる」「この第III相試験の開始は、高品質のバイオシミラーを提供することで、重篤な慢性疾患あるいは生命を脅かす疾患を患っている患者の生活を改善するというわれわれの取り組みを強化する。 さらに、これらの洞察はまた、プレーヤーが強力なペースで加速し、2021年から2027年の在職期間を通じて世界のアダリムマブバイオシミラー市場の競争状況内で曲線よりも早く維持することを容易にすることができます。
1These biologics are being developed to treat auto immune disorders like arthritis, cancer, infertility and stroke. " "The initiation of this Phase III study reinforces our commitment to improving the lives of patients suffering from serious chronic or life-threatening diseases by providing high-quality biosimilars. (参考1)症例の約80%-90%を占めるのが、乾癬の最も一般的な形態である。 これらのプレーヤーは、合併、パートナーシップ、コラボレーションなどの方法を専門としています。
さらに、選択した細胞の製造条件を検討して、全体的な品質が先行品の変動範囲内に収まる様に最適化します (図2)。
そのためジェネリック医薬品よりも多くの品質試験が必要とされ、最終的に臨床試験を行って同等・同質であることを確認しています。
存続期間満了日: 2026. 存続期間延長登録出願されていることからプレベナー13水性懸濁注を保護する。