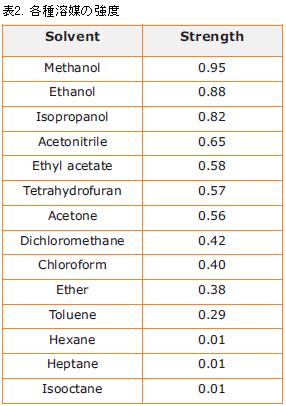
各種溶媒の極性に関する指標

などの乾燥剤による乾燥や、操作により精製が行われる場合が多い。

などの乾燥剤による乾燥や、操作により精製が行われる場合が多い。
ヘキサンやベンゼンは炭素と水素しか持っておらず、分子内で電子の偏りは起こらないためこれらの溶媒は無極性溶媒になります。
よく使用する有機溶媒の紹介! ヘキサン ヘキサンは実験室で利用する無極性溶媒で最も有名なものだとおもいます。
このため、強毒性の溶媒から、比較的低毒性な溶媒 時に水 への置き換え、あるいは溶媒量の削減 時に無溶媒反応 、といった化学プロセスの開発が行われている。
水は 、溶質の正または負の電荷に引き付けられるため 、極性 として機能し ます。
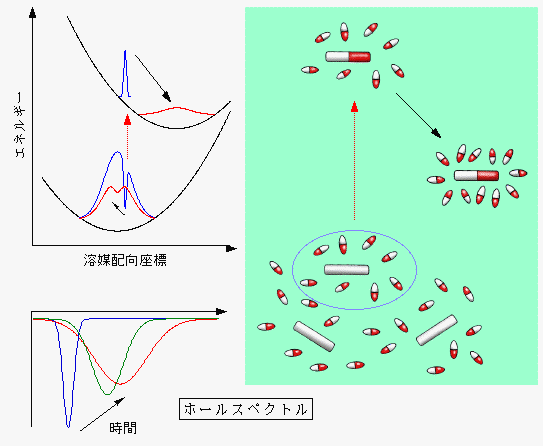

その他、に障害を起こすものも多い。 担体を通常のシリカゲルではなく、表面修飾がジオールやカルボン酸で就職されたシリカゲルプレートを使用すると上がりやすくなるかもしません。 やあるいはなど。
溶媒はを示す• P'はk'および選択性の調節の指標となる。
好みの問題です。
芳香族よりも脂肪族のほうが極性が低いことが多いです。
ここでは水に塩が溶けるという現象を分子の目線から見てみましょう。
逆にODSをはじめとする逆相系LCでは、移動相の極性が固定相の極性より大きいので、極性の大きい試料成分ほどk'が小さくなり早く溶出します(図1)。
またに用いる。
溶解性の定量的な指標としてはが用いられる。
また、高極性溶媒と低極性溶媒 例えば、水とヘキサン、と)とは相互に混和せず、良く振り混ぜてもすぐに二層に分離する事が多い。
水が極性溶媒である理由 各水分子の形状は、他の水分子や他の物質との相互作用の仕方に影響を与えます。 炭素原子が両方向の酸素原子から共有電子対を引っ張られている力は、 力の大きさが同じで、反対向きで、一直線上にありますよね。
逆に 無極性溶媒はプラスチックを溶かすものが多いです。
その原理としましては、 違う元素同士の場合、当然ですが、 違う元素なので電気陰性度の大きさにも違いがあります。
分液で除去する手順 ここではDMFを溶媒として使っている反応を無機塩の水溶液で反応停止したものを想定します。
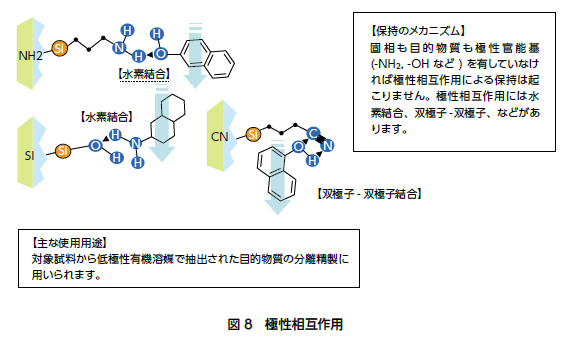
O-化学解説(英語)• 組み合わせの選び方というものはあまり無く、組み合わせや比率によって、展開パターンは大きく変化するので、いろんな組み合わせを試してみるのが重要です。 ここまで引っ張っておいて分液かよ、と思うかもしれませんが、水溶性と疎水性の有機化合物を分けるときは分液が一番です。 この場合のP'は次式によって求められます。
16よって、 は分子全体で見ると、が生じていない(を打ち消しあっている)ので、 無極性分子となります。
安全性 [ ] 水は、不燃かつ無毒である。
8位 ブタノール:酢酸:水 アミノ酸や糖類など極性が高い化合物を分けるときに使用します。
各水分子のわずかに正の水素側は、他の酸素原子と他の分子の負に帯電した領域を引き付けます。

一方、水やのような高沸点溶媒の乾燥には、加熱・減圧・気流下等の条件が必要である。 水とヘキサンの誘電率は、それぞれ80と1. 1位 ヘキサン:酢酸エチル ヘキサンと酢酸エチルの組み合わせは 王道中の王道です。
17プロトン性溶媒の共通する性質としては、以下がある。 この状態ではより極性が高くなって上がりにくくなります テーリングなどが起きる。
ヘキサン:酢酸エチルでは全く上がらない時に、試してみると良いかもしれません。
TLCで見るときは100:1とかでも使用しますが、カラムに応用するとあまりうまく行かない気がします。
THFとアセトニトリルの組み合わせは他の展開溶媒と比べて溶出パターンが結構変わるので試してみると良いです。