酸化数のルールを覚えて酸化剤・還元剤を見抜く方法を解説!


ちなみに過マンガン酸カリウムは硫酸を加えた水溶液中で酸化剤としてはたらく。


ちなみに過マンガン酸カリウムは硫酸を加えた水溶液中で酸化剤としてはたらく。
多原子イオンの酸化数 複数の原子で構成されている 多原子イオンも、その価数=酸化数となります。 したがって,酸化剤自身は還元されることになります。
2の過程でH 2Oを加えたことにより、いま右辺には8つのHが存在することになります。
ただし酸化剤がどんな生成物になるか、 還元剤がどんな生成物になるか、 に関しては覚えるしかありません。
過マンガン酸カリウムのマンガン原子の酸化数は+7で,硫酸マンガンのマンガン原子の酸化数は+2です。

では、ここまで覚えられたとして、残りの部分はどのように完成させればよいのでしょうか。 例) 残念ながら、 各物質の反応前後は、覚えるしかないのでがんばって覚えてください。 1.反応前と反応後の化学式を書く。
工程は酸化剤のときとあまり変わりません。
酸化剤は電子を奪って自分のものにする物質なので 左辺に電子があり、還元剤は電子を放出して相手に与える物質なので 右辺に辺に電子があります。
表でまとめてみるとこうなります。
高校「化学基礎」の内容から、ちょっとしたスキ間時間に確認できるように、重要事項をまとめてみました。


2.両辺のO原子の数を「H 2O」を使ってそろえる。
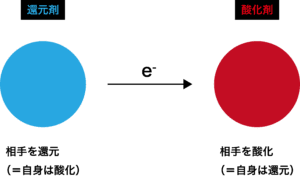
これを、相手目線で言い換えてみると、どのように言い表すことができるでしょうか?酸化還元反応において、どの物質が酸化剤・還元剤としてはたらいているかを調べるためには、それぞれの物質中に含まれる原子の酸化数が、反応の前後でどのように変化しているかを見ればOKです。
また、金属の酸化還元反応が頻出ですので、金属単体と酸化剤の反応では、金属単体が還元剤となり、金属イオンと酸化剤では金属イオンが酸化剤となっています。
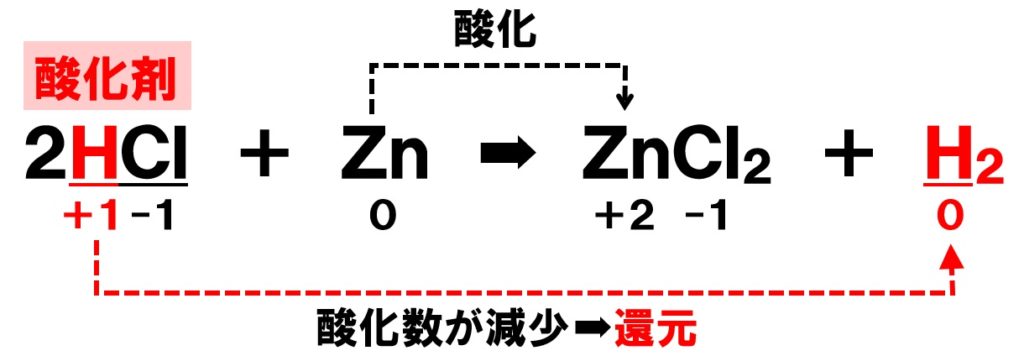
ところで、酸化の定義は「単体の原子がどれだけ電子を失ったか」でした。
還元剤は「相手を還元する物質」であり, 自身は酸化されることを理解しておきましょう。
水素原子の少ない方にH +を加えて,数を合わせる。
それぞれの反応の下線部の元素について, みてみましょう。
ヨウ化物イオンを酸化したのは,過酸化水素です。
さて, ご質問いただいた問題についてご説明します。

酸化剤は,相手の電子e -を奪うことで,相手を電気的に正の方へと変化させます。 このように相手に対してどのようなことをしているのか、ということに注目して酸化還元反応を見たとき、 相手を酸化した物質を酸化剤、 相手を還元した物質を還元剤とよんでいます。
15また,これらのイオンは反応前後で変化しないために省略されていたので,反応後にも同じだけ残っているはずです。
シュウ酸も両辺4でそろっているのでそのままでよい。
ハロゲンの単体の酸化剤としての強さは, F 2>Cl 2>Br 2>I 2 です。
酸化と還元の見分け方について。

ここでは過マンガン酸カリウムとシュウ酸の場合のイオン反応式をつくってみる。 次に出てくる半反応式は重要ですが、先ずは酸化数ですよ。 マンガン(II)イオンMn 2+になるからです。
したがって、 酸化剤、還元剤単独で反応を完結させることはできないので、酸化剤だけ、還元剤だけ、の反応を表す式は、まだ半人前で1つの反応としては完結されたものではないからです。
Web画面のデザインはイメージです。
詳しくはをご覧ください。
多くの生徒が、半反応式の作り方をマスターするのを諦めて丸暗記に走ってしまいますが、本来、 この作り方さえ覚えれば、あとは半反応式を自分で作ることができます。
1.反応前と反応後の化学式を書く。
酸化剤と還元剤との間で電子のやりとりを行います。
暗記した物質やイオンを書く。
これらがそれぞれの酸化剤、還元剤の半反応式です。