反応速度と温度の関係

Dは比例定数であり、拡散係数と呼ばれている。 反応は活性化エネルギー以上のエネルギーを持った分子によって起こりますが、ある温度での活性化エネルギー以上の分子の割合というのは、マクスウェル・ボルツマン分布によって計算できます。 Excelでやればすぐにできます。
8

Dは比例定数であり、拡散係数と呼ばれている。 反応は活性化エネルギー以上のエネルギーを持った分子によって起こりますが、ある温度での活性化エネルギー以上の分子の割合というのは、マクスウェル・ボルツマン分布によって計算できます。 Excelでやればすぐにできます。
8・並行反応 並発反応、競争反応、分岐反応 一つの物質から複数の物質を生成するときの反応を 並行反応という。
アレニウスの式の2つの使い方【例題で解説】 アレニウスの式は以下の用途で用いられます。
頻度因子 A 、活性化エネルギー E をアレニウスパラメーターといいます。
ザッツオールです。
・逐次反応 連続反応 反応物が中間生成物を介して最終生成物となる反応を 逐次反応 連続反応 という。 (もちろんこのまま手計算で解いても良いでしょう)。
5年後の1889年、によりこの式の的根拠が与えられた。
4,563,429 Hits Please click button below to increase rating of my blog. スポンサードリンク 【参考資料】 JISK7226 「プラスチック-長期熱暴露後の時間-温度限界の求め方」 一色節也. 反応速度定数kと温度Tの関係については、アレニウス式が成立する。
つまり、このグラフから活性化エネルギーEaと頻度因子Aの値を求めることができるのである。
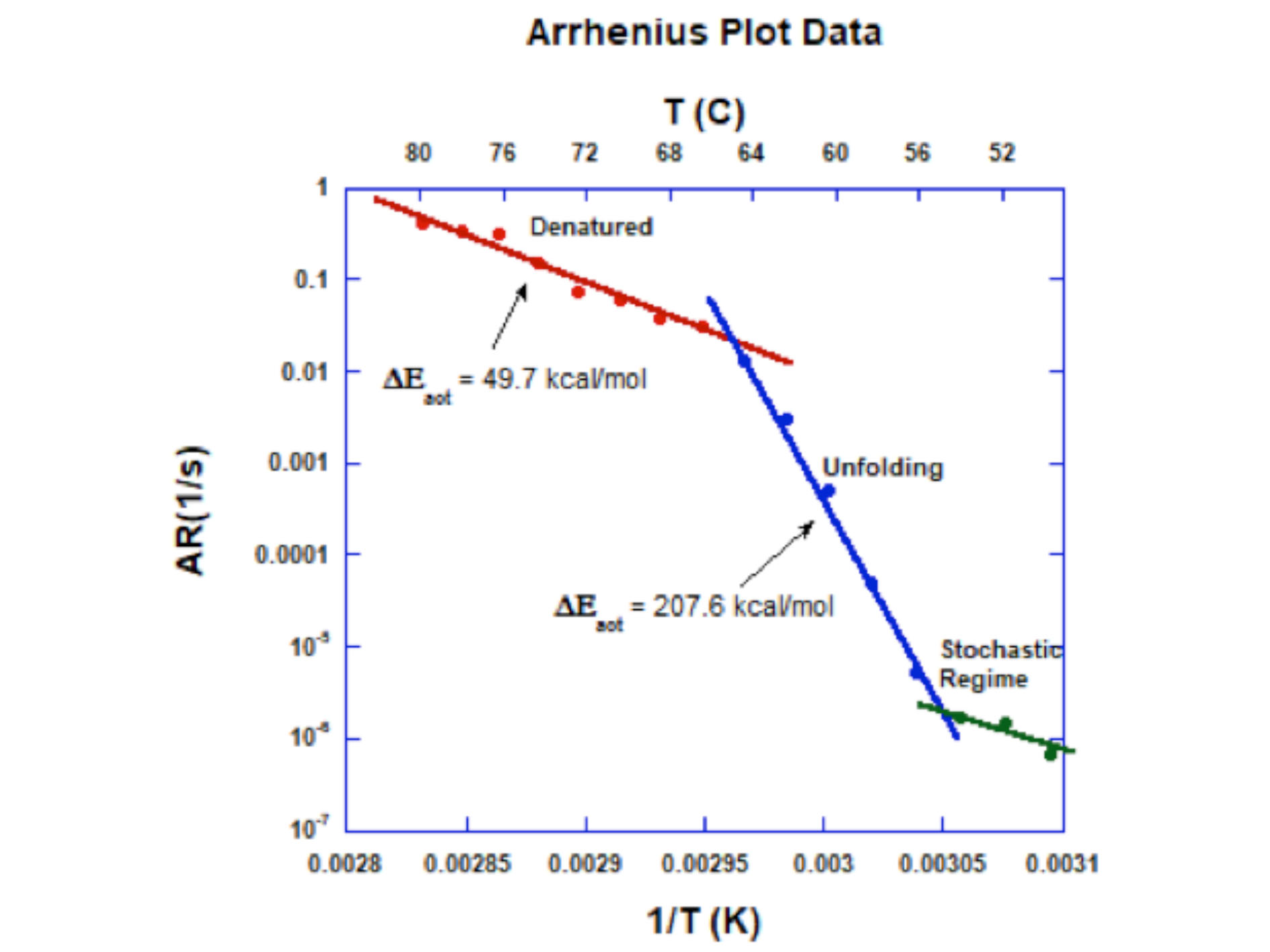

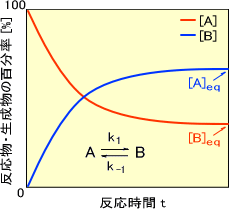
なお、可逆反応のときの反応物・生成物の百分率-反応時間曲線は次のように表わされる。 アレニウスは 1903 年に電解質の解離の理論に関する業績によりノーベル化学賞を受賞しています。 この考え方を元に、劣化予測式(寿命予測式)にこのアレニウスプロットが利用されています。
13今回は10秒ずつ区切った例で説明をしましたが、この区切りは1秒でも何秒でもOKです。
<温度変化における速度定数の変化> 温度変化による速度定数の変化を「反応速度定数の温度依存性」といい、活性化エネルギーが大きいほど反応速度定数の温度依存性は大きい。
脚注 [ ]. 要するに球が山を越えることができなければ生成物側に移行することができないため、反応は進行しない。
対数表を読んで変換していた?いえいえ、「対数をプロット」するための特別なグラフ用紙を使っていたのです。

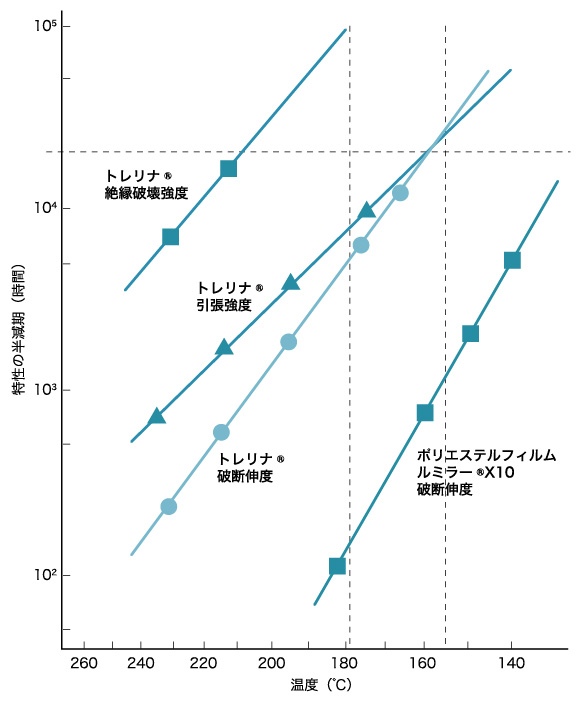
医薬品の安定性を比較するにあたっては、アレニウスプロットが利用される。
医薬品の安定性試験では「吉岡澄江、医薬品の安定性、p. 衝突回数が多ければそれだけ反応する分子の数が多いはずである。 ここで衝突の回数は頻度因子で表され、活性化エネルギーの峠を超える確率はボルツマン分布で表される。
下のようにAという物質がB,C,Dという物質を生成し、それぞれの速度定数がk B,k C,k Dとする。
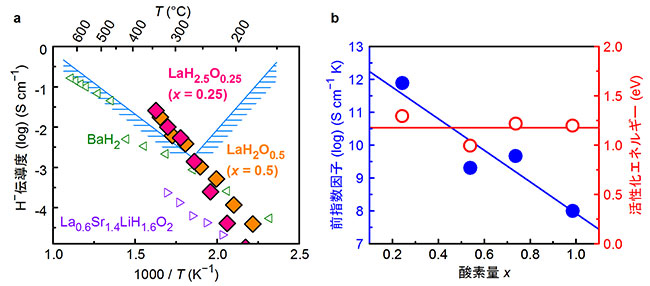
2 温度(横軸)に対する反応速度(縦軸)のプロットデータとフィットさせた曲線 フィッティングの結果から,頻度因子:8. なお、このときの速度定数kはk B,k C,k Dの和となる。
アレニウスの式と活性化エネルギーの概要復習 まず、アレニウスの式について解説します。
アレニウスの式の特徴 アレニウスの式は『 反応速度定数k』に関する式です。 まず、おおよその式変形のイメージをしてみましょう。 よって、次の式を導き出すことができる。
8ある温度(T 1)では、反応速度定数kが同じになり、また、それぞれの活性化エネルギーの関係がE aA>E aBであることから、上記のようなプロットが得られる。
立体障害が大きいような分子の場合は、Pは小さくなり、必然的に頻度因子Aも小さくなります。
すると以下のようなグラフが作成でき、近似曲線を追加すると傾きと切片の値がわかります。
アレニウスの式には反応速度定数に関係する 全てのパラメータが含まれておりとても便利です。


その化学反応は分子同士の衝突により起こりますが、分子が持つエネルギーが下記図の活性化エネルギーE aより大きい場合のみ、化学反応が起こります。 反応速度ではなく、 反応速度 定数であることに注意! よく大学の問題演習で出されるのは、既に 反応速度定数の表が与えられている場合が多いです。
17関連記事 アレニウスの式には気体定数が含まれるが、気体にしか適用されないのか? アレニウスの式において気体定数Rが含まれていますが、気体にしか適用できないのでしょうか? 実は気体の反応だけでなく、液体であっても化学反応であればアレニウスの式に従います。
通常のグラフ用紙には均等な間隔で目盛りが付けてありますが、対数グラフ用のグラフ用紙では軸に対数間隔での目盛りがついています。
こういう流れです。
化学反応のアレニウスパラメーターを求めること、反応速度定数を予測することは化学製品のプロセス設計に必要不可欠です。

この形式を用いて実測された反応速度とそのときの温度の逆数をにプロットすれば、の手法を用いて係数 m、 b を求めて活性化エネルギーなどを実験的に求めることができる。 このような考え方を元に、アレニウスは化学反応の速度を以下の式で表しました。 5次で進行するのか、といった重要なことは当たり前ですがアレニウスの式からは全く分かりません。
1283171E10,活性化エネルギー:168170,がそれぞれ得られました.ちなみに,演習書の解としては,頻度因子:5. 等価加硫量についてはこちらの記事をご覧ください。 与えられた温度Tと速度定数kを入力します。
それでは、具体例を用いてアレニウスの式から活性化エネルギーを求める方法について下で解説します。
ある温度の反応速度定数を予測する この2つの使い方を例題を用いてわかりやすく解説していきます。
この記事はなが全く示されていないか、不十分です。