気体の状態方程式とは?体積との関係から練習問題まで|高校生向け受験応援メディア「受験のミカタ」


なので,歴史的には「ボイル・シャルルの法則から状態方程式が導かれた」が正しくても,物理的には「状態方程式を式変形したものがボイル・シャルルの法則」と見るのが正しいでしょう。 10 molというように、明示的に有効数字が2桁であることが示されていますから、 とする方がよいでしょう。 状態方程式を変形させて求めてみましょう。
19

なので,歴史的には「ボイル・シャルルの法則から状態方程式が導かれた」が正しくても,物理的には「状態方程式を式変形したものがボイル・シャルルの法則」と見るのが正しいでしょう。 10 molというように、明示的に有効数字が2桁であることが示されていますから、 とする方がよいでしょう。 状態方程式を変形させて求めてみましょう。
19ですから、nと気体定数Rは一定になり、 となります。 何度も読み返してしっかりマスターしてください!• この気体の分子量を求めよ。
常温・常圧で液体である物質でも、揮発性の物質であれば、上述の式を利用してその分子量を求めることができます。
それぞれの単位は、問題で与えられた気体定数の単位で判断します。
理想気体と実在気体についてのグラフは記述問題でよく出題されますし、状態方程式は化学の計算問題でたくさん使います。
現実に存在する気体のことを,理想気体に対して実在気体と呼びます。 ぜひご覧ください!. 低圧の場合、気体の分子どうしが離れていて、分子間力や分子自身の体積を無視できますから、理想気体に近い性質をもちます。
したがって,気体の分子量を知るためには,モル質量がわかればよいのです。
(単位はあまり気にしなくて良いです。
気体の状態方程式は非常に便利な公式となります。


では,標準状態の気体にボイル・シャルルの法則を適用してみましょう。
40molの理想気体が占める体積は何m 3か。 慣れてくるとそうします。
諸性質 [ ] 理想気体の状態方程式から導かれる性質として以下のものがある。
そして、 1 2 が成り立たない場合は、 1 式を補正するれば良いだけだと、軽い気持ちで考えておけば良いでしょう。
気体の体積 v は,物質量 n と絶対温度 T に比例し,圧力 p に反比例することが分かります。


ボイルの法則は温度が一定のとき,シャルルの法則は圧力が一定のときという条件がつきましたね。 しっかり練習して、確実に素早く解けるようにしてください。 状態方程式を使えないと、何もできません。
8実在気体でも高温・低圧であるほど理想気体に近くなる。
理想気体の状態方程式を使うと,気体のモル質量を求めることができます。
Contents• また、有効数字二桁で答えよ。
10 3 Pa• 大切なのは、鉛筆だけでなくジュースやボールペンでも12本で1ダースとするのと同じで、 どんな原子や分子、イオンでも同じ数だけ集めて1molとする点です。
どの単位を用いているかによって、問題の数値をそのまま使ってよいかなどが変わってきます。 このような「理想気体」というものは、そもそも存在しない。
一方で、 実際に存在する気体のことを実在気体 といいます。
3] 同じ容積 V[m 3]をもつ容器A,Bを,下図のように体積の無視できる細い管でつなぎ,温度 T[K],物質量 n[mol]の理想気体を入れる。
覚えておかなければならないのは気体定数ですので何度も何度も見ておいてください。

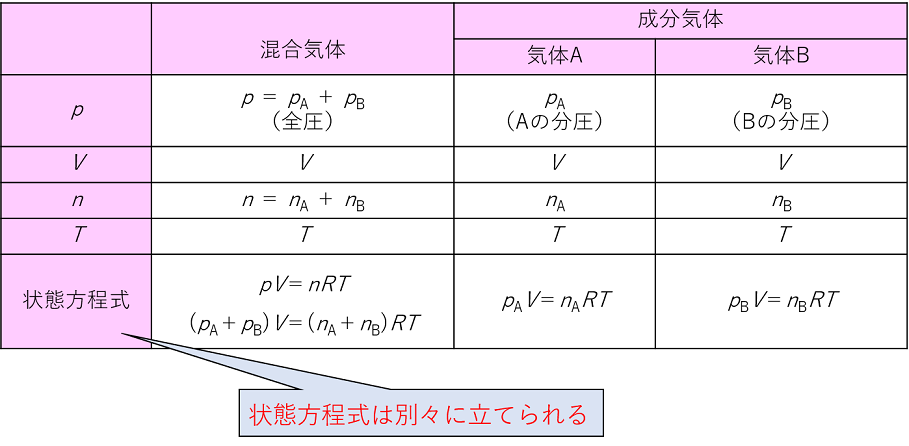
ご参考になれば幸いです。
一応両方やって見ましょう。 ただし,ボルツマン定数を1. それらの数をそのままの数で表すのは、無駄に数字を大きくするだけで意味がありません。
【低圧にする理由】 気体分子自体の大きさ(体積)が相対的に小さくなるためです。
何故なら、密度が0に近付けば、分子の運動に際し、お互いがぶつからずに、分子自身の体積が無視できるようになる。
例えば気体であれば、ピストンのついている容器に気体を入れると、気体は容器の中を熱運動してピストンを押します。
また、極性をもつ分子も分子間力が大きいため、ずれが大きくなります。 この法則が厳密に成り立つと考えた気体を理想気体といいます。
これはすぐ言えるようにしておきましょう。
ここでもシリンダーに閉じ込められた気体分子をイメージしてみましょう。
TはTemperature 絶対温度 :単位 K ケルビン。