pH(ペーハー)の正式名称や意味とは?定義式や温度との関係も!


弱酸は水溶液中で一部しか電離せず、電離度が1に比べてかなり小さい酸のことを言うのでしたね。
5にはしない。 CH3COOHの濃度が0. ですから、味だけで液性を判断することはできませんし、そもそも劇薬もあるのですから何でもなめてみるというわけにもいきません。
記号は数値の左側に空白を入れずに書く。
Pure and Applied Chemistry 57 3 : 531—542. また、この計算結果を何かに利用する場合には自己責任でご利用ください。
。

反応前、反応量、反応後の各々濃度を表にまとめるとわかりやすいです。 3 弱酸 [ ] 溶液のpHはを使って見積もることができる。 ちなみに、、(極限を使ってみる:上級編) 今回硝酸HNO 3の濃度を1. ・緩衝作用とは? ・酢酸 CH3COOH)と酢酸ナトリウム(CH3COONa)の解離(電離)と緩衝作用 ・酢酸の緩衝溶液のpHを計算してみよう【酢酸の解離平衡時の平衡定数】 というテーマで解説していきます。
18仕事で使う場合には試薬で計測しながらpH調整してください。
標準溶液 S のpHは次式で与えられる。
このページでは pHについて解説しています。
010と比較して非常に小さい値なので、 以下のような近似ができる。
pHは溶液中の水素イオンの濃度を元にした酸性・アルカリ性の度合いを表す単位であり、7付近を中性としてそれより小さい値を酸性、大きい値をアルカリ性として定義している。
2標準溶液: 0. 標準溶液のpH 標準溶液のpHを定める方法のひとつは、ある溶液のpHを定義値として固定することである。 , p. pHの読み方と由来 [ ] pHの読みは、「ピーエッチ」 、「ピーエイチ」(英語読み )、または「ペーハー」(ドイツ語読み )などである。
1372 「ピーエッチ」、初版第一刷、2002-12-01、大修館書店• 田中元治『酸と塩基』〈基礎化学選書 8〉、1971年。
水のイオン積 K w が温度によって変わるので、7. 皆さんも省略しないようにして下さい。
中性りん酸塩pH標準液:IUPACと同じ• 1以下である。

あくまでも "目安" です。
ちなみに強いアルカリ性によって感じられるヌメリは、肌が溶けていることが原因なので注意しましょう(塩素系の漂白剤を触った時など)。
ただ1つ「水酸化ナトリウム水溶液」だけは「酸」を含んでいるのにアルカリ性となりますが、この水溶液を酸性と間違える受験生はいないでしょう。
ただし文字は英語表記。
国際純正応用化学連合(1993)。

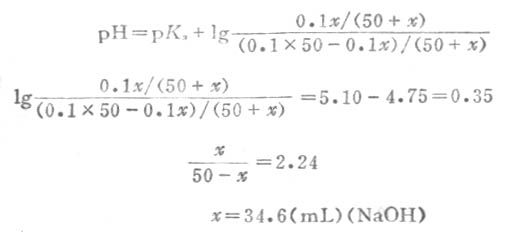
このため単独イオンの活量で定義される厳密な意味でのpHは測定が不可能であることになる。 NaOH1モルは、40gですから0. ポイントは、「水素イオン濃度」と『 水のイオン積』です。
これらの標準液の調製法とpHの典型値は、JIS Z 8802 に記載されている。 この液体にめっきさせたいものを入れ、被膜を形成することが基本です。
05 mol を水 1 kg に溶解• Proceedings of the National Academy of Sciences of the United States of America 96 7 : 3455—3462. 電離定数は、解離定数の一部と考えられるので解離定数といわれることもあります。
このように、共通のイオンが反応に関わっており、共通のイオンの発生が抑えられていることを共通イオン効果ともよびます。
この計算結果は、弱酸の水溶液を水で薄めていくとアルカリ性を示すようになる、ということを意味するので、明らかにおかしい。
ただし、これは概念上の定義で実測できない値であるので、実際のpH測定に当たっては JIS Z 8802 に規定されているを用いる。
十分に希薄であれば、質量モル濃度から計算したpHはモル濃度から計算したpHに等しい。
以下で緩衝作用について、具体例を交えて解説していきます。
1より小さい水溶液)に限れば、pHを水素イオン活量の逆数の対数とみなせる、ともしている。