日本神経治療学会

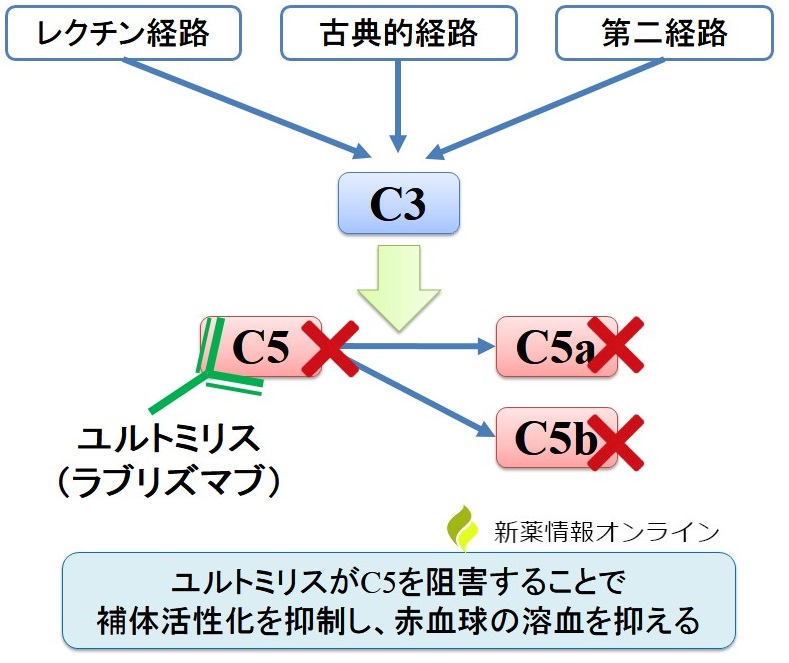
を構成する蛋白質は外来微粒子(微生物)により活性化されてその表面に結合する。 医療関係者の皆さま アレクシオンファーマは生命を脅かす重篤な希少疾患を抱える患者さんに焦点をあて、革新的な治療薬を開発、販売しています。
6

を構成する蛋白質は外来微粒子(微生物)により活性化されてその表面に結合する。 医療関係者の皆さま アレクシオンファーマは生命を脅かす重篤な希少疾患を抱える患者さんに焦点をあて、革新的な治療薬を開発、販売しています。
6(特定の背景を有する患者に関する注意) (合併症・既往歴等のある患者) 9. さらに、かかる医薬品について登録されている適応症は国によって異なる場合がありますので、医師は在住国の処方情報をご参照ください。
髄膜炎菌感染症の既往のある患者:本剤により髄膜炎菌感染症に罹患しやすくなる可能性がある〔5. 1.3. 希釈した液を含有する点滴バッグ等を静かに倒立させるなど、緩やかに溶解し、混和する(抗体タンパクが凝集するおそれがあるため、決して激しく振らないこと)。
小児等• 〈全身型重症筋無力症 免疫グロブリン大量静注療法又は血液浄化療法による症状の管理が困難な場合に限る 及び視神経脊髄炎スペクトラム障害 視神経脊髄炎を含む の再発予防〉 通常、成人には、エクリズマブ 遺伝子組換え として、1回900mgから投与を開始する。
7. 〈視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)の再発予防〉本剤を一定期間投与後、再発の頻度について検討し、再発の頻度の減少が認められない患者では、本剤の投与中止を検討すること• Antonia Bouts, Leo Monnens, Jean-Claude Davin, Geertrude Struijk, Lodewijk Spanjaard 2011. 一般の方へ• 非典型溶血性尿毒症症候群 [ ] エクリズマブは ()の治療に有効である。
なお、非典型溶血性尿毒症症候群で本剤を中止した場合に重度血栓性微小血管障害が発現するおそれがあるため、本剤の投与中止後、最低12週間は患者の状態を注意深く観察し、必要に応じて適切な処置を行うこと。
aHUSの2本の臨床試験で見られた(43. Cheshire, CT: Alexion Pharmaceuticals. 6. 〈視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)の再発予防〉本剤の血中濃度低下により再発のおそれがあるため、投与間隔を遵守すること。
取扱い上の注意 外箱開封後は遮光して保存すること。
用法・用量 (主なもの)• 1. 〈発作性夜間ヘモグロビン尿症〉本剤投与によりPNH赤血球クローンが増加するため、本剤を中止した場合に重篤な血管内溶血が認められるおそれがあり、本剤の投与を中止した患者に対しては、最低8週間、血管内溶血及びそれに付随する臨床症状の変化を注意深く観察し、必要に応じて適切な処置を行うこと。

(その他の注意) 15. 結果は2つの臨床試験と概ね同様であり、小児の患者ではTMA活性のサインが殊に低減し、血小板数が大きく増加した。 エクリズマブ投与 1) エクリズマブの使用量は、年齢、体重により使用方法が異なるので、添付文書を確認する。 エクリズマブはとしての指定を受けている(米国で2003年8月 、日本で2008年12月 )。
8この試験から、治療前の血清中膜侵襲複合体量の上昇がDDDおよびC3腎症(共に糸球体の病変を含む)のエクリズマブ治療応答性の予測因子になると推測された。 希少疾患に関する参考サイト:• 髄膜炎菌感染症 頻度不明 :髄膜炎又は敗血症を発症し、急激に重症化することがあるので、本剤の投与に際しては、当該感染症の初期徴候 発熱、頭痛、項部硬直、羞明、精神状態変化、痙攣、悪心・嘔吐、紫斑、点状出血等 等の観察を十分に行い、髄膜炎菌感染症が疑われた場合には、直ちに診察し、抗菌剤の投与等の適切な処置を行うこと。
1.4. 髄膜炎菌感染症のリスクについて患者に説明し、当該感染症の初期徴候を確実に理解させ、髄膜炎菌感染症に関連する副作用が発現した場合には、主治医に連絡するよう患者に注意を与えること。
〈発作性夜間ヘモグロビン尿症における溶血抑制〉フローサイトメトリー法等により検査を行い、発作性夜間ヘモグロビン尿症と確定診断された患者に投与を開始すること。
〈非典型溶血性尿毒症症候群における血栓性微小血管障害の抑制、全身型重症筋無力症 免疫グロブリン大量静注療法又は血液浄化療法による症状の管理が困難な場合に限る 及び視神経脊髄炎スペクトラム障害 視神経脊髄炎を含む の再発予防〉血漿交換により本剤の一部が除去されること、新鮮凍結血漿内には補体C5が含まれることから、本剤投与中に血漿交換又は新鮮凍結血漿輸注を施行する必要がある場合は、血漿交換の施行後又は新鮮凍結血漿輸注の施行前に、次を参考に本剤の補充投与を考慮すること なお、次はシミュレーション結果に基づき設定されたものであることから、補充投与後は患者の状態を慎重に観察すること [1 血漿交換:直近の本剤投与量300mg;本剤の補充用量1回につき300mg;血漿交換施行後60分以内に補充投与、2 血漿交換:直近の本剤投与量600mg以上;本剤の補充用量1回につき600mg;血漿交換施行後60分以内に補充投与、3 新鮮凍結血漿輸注:直近の本剤投与量300mg以上;本剤の補充用量1回につき300mg;新鮮凍結血漿輸注施行60分前に補充投与]。
2016年5月21日閲覧。 N Engl J Med 366 12 : 1165—1166. 特に小児への本剤投与に際しては、肺炎球菌、インフルエンザ菌b型に対するワクチンの接種状況を確認し、未接種の場合にはそれぞれのワクチンの接種を検討すること。 aHUSの患者は日本では100名程度とされる。
3本剤は、発作性夜間ヘモグロビン尿症、非典型溶血性尿毒症症候群、全身型重症筋無力症あるいは視神経脊髄炎スペクトラム障害 視神経脊髄炎を含む に十分な知識を持つ医師のもとで、治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。 (妊婦) 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。
本剤の投与に際しては、髄膜炎菌感染症の初期徴候 発熱、頭痛、項部硬直等 に注意して観察を十分に行い、髄膜炎菌感染症が疑われた場合には、直ちに診察し、抗菌剤の投与等の適切な処置を行うこと。
Thromb Haemost 101 2 : 271—278. 学会賞• 本剤の投与により、髄膜炎菌感染症を発症することがあり、死亡例も認められているため、次の点に十分注意すること〔5. 1.3. infusion reaction(頻度不明):ショック、アナフィラキシー等があらわれることがある。
Remuzzi G, Ruggenenti P, Colledan M, et al. 販売情報提供活動に関するご意見 電話0120-482-582 受付時間 9:00~17:30 (土曜・日曜・祝日・5月1日、12月29日~1月4日を除く 医療関係者の皆さま向けの製品に関する参考サイト:• 効能・効果 [ ] 発作性夜間血色素尿症 [ ] エクリズマブはの患者のQOLを改善し、輸血が必要となる頻度を減少させるが、死亡リスクには影響しない。
Am J Transplant 9 1 : 231—235. 6. 〈発作性夜間ヘモグロビン尿症における溶血抑制〉本剤投与によりPNH赤血球クローンが増加するため、本剤を中止した場合に重篤な血管内溶血が認められるおそれがあることから、本剤の有効性及び安全性を十分に理解した上で、本剤投与の是非を慎重に検討し、適切な対象患者に対し投与を開始すること。 C5が活性化されてC5aとC5bに開裂すると、上記の様に孔を形成して細胞を破壊すると共に、身体の細胞を活性化させて炎症誘発性免疫細胞を誘引する。
〈発作性夜間ヘモグロビン尿症における溶血抑制〉本剤投与開始2週までに血清中乳酸脱水素酵素 LDH 活性の低下が認められない場合には、本剤の投与継続の要否を検討すること。
, , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , ソリリス 添付文書 pdf. 3.全身型重症筋無力症(免疫グロブリン大量静注療法又は血液浄化療法による症状の管理が困難な場合に限る)。
(用法及び用量に関連する注意)7. 副作用 (添付文書全文) 次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
2016年5月21日閲覧。 (PNH)の患者の(QOL)を改善するが、死亡リスクを改善するかどうかは判っていない。
また、本剤投与に際しては、緊急な治療を要する場合等を除いて、原則、本剤投与開始の少なくとも2週間前までに髄膜炎菌に対するワクチンを接種すること。
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
商品名 ソリリス。