医療機器の定義|医療機器とは
【一般的名称等の確認】 (PMDAホームページ) 【基本要件基準への適合性チェックリスト】 (厚生労働省ホームページ 「登録認証機関制度について」の7.指定高度管理医療機器等の適合性チェックリスト) 【適合性認証基準】 *指定高度管理医療機器等 平成17年3月25日 *指定体外診断用医薬品 平成17年3月29日 認証費用のお見積 認証費用につきましてはご依頼をいただければ詳細をお見積もりいたします。
15
【一般的名称等の確認】 (PMDAホームページ) 【基本要件基準への適合性チェックリスト】 (厚生労働省ホームページ 「登録認証機関制度について」の7.指定高度管理医療機器等の適合性チェックリスト) 【適合性認証基準】 *指定高度管理医療機器等 平成17年3月25日 *指定体外診断用医薬品 平成17年3月29日 認証費用のお見積 認証費用につきましてはご依頼をいただければ詳細をお見積もりいたします。
154KB] 様式第69 報告書受理通知書 [28KB] [33. 9KB] 様式第63-3 医療機器・体外診断用医薬品製造業登録証 [29. 三者協議会 厚生労働省医薬・生活衛生局、医薬品医療機器等法登録認証機関協議会及び一般社団法人 日本医療機器産業連合会(略:医機連)の三者は、 三者協議会を設置し、認証に関する様々な事項に関する協議を行っている。 1KB] 様式第75-23 外国製造再生医療等製品再審査確認・調査申請書 [39. 登録認証機関 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第23条の6第1項の規定により登録された認証機関です。
5KB] 様式113(3) 輸出用再生医療等製品適合性調査申請書 [39KB] [59. 3KB] 様式第68-2(1) 追加的調査結果証明書 [41. 8KB] 様式第63-32 外国製造医療機器・体外診断用医薬品製造販売承認承継届書 [40. 2KB] 様式第63-24(2) 外国製造体外診断用医薬品製造販売承認事項軽微変更届書 [38KB] [57KB] 様式第63-25 外国製造医療機器・体外診断用医薬品適合性調査申請書 [41. 3KB] 様式第63-20 医療機器・体外診断用医薬品製造販売承認承継届書 [39KB] [54. (2)一部変更申請(様式第六十五)• 本チェックリストは、三者協議会において、厚生労働省、PMDA、ARCB のご協力のもと作成したものです。
2KB] 様式第75-13 再生医療等製品再評価確認・調査申請書 [35KB] [58KB] 様式第75-14 再生医療等製品再評価確認等結果通知書 [33KB] [50. クラスIII(高度管理医療機器)• 3KB] 様式第105 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第69条の2第1項の規程に基づいて立入検査、質問又は収去を行う独立行政法人医薬品医療機器総合機構の職員であることの証明書 [32. 対象企業には新しいデータ提出シートをメールにてお送りしておりますので、必ず最新版をご利用いただきますようお願いいたします。
各機関における認証業務の範囲は、をご参照ください。

製造業者は、この移行期間中に技術文書を改定し、新しい要求事項に対応しなければなりません。 5KB] 様式第75-10 再生医療等製品再審査確認・調査申請書 [36KB] [62. 8KB] 様式第63-11 医療機器・体外診断用医薬品適合性調査申請書 [41. 9KB] 様式第94-4 再生医療等製品販売業許可更新申請書 [39. 指定管理医療機器 医療機器はそのリスクに応じてクラス分類され、それぞれに必要な手順や手続方法が異なります。 8KB] 様式113(1) 輸出用医薬品・医薬部外品適合性調査申請書 [40KB] [69. その機器の人体等に及ぼす危険度に応じ、クラス分類がされています。
4承認取得後は、承認整理をして製造販売届書の提出が必要である。
8KB] 様式第73 登録認証機関業務規程認可申請書 [34KB] [41. 8KB] 様式第14 医薬品・医薬部外品・化粧品・再生医療等製品製造業許可更新申請書 [42KB] [78. 各項目の内容については、リスト作成日時点での情報を反映させており、空欄の場合には、当該項目は非該当となります。
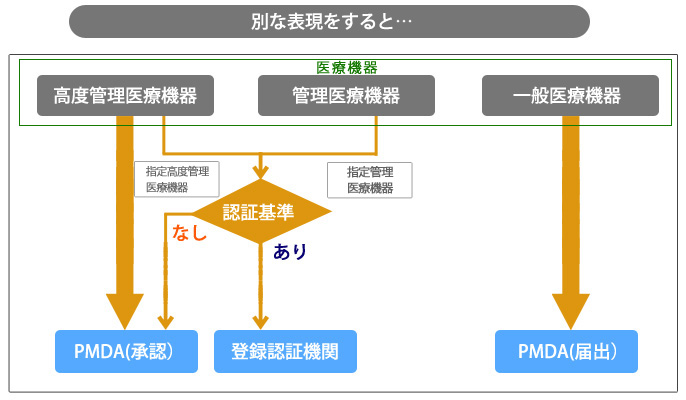
2KB] 様式第67(2) 外国製造指定高度管理医療機器等適合性調査申請書 [39. 5KB] 様式第66(2) 指定体外診断用医薬品認証事項軽微変更届書 [35KB] [52. 3KB] 様式114 輸出用医薬品・医薬部外品・化粧品の製造等・輸入届書 [39. 第三者認証とは 厚生労働大臣が基準を定めて指定する高度管理医療機器、管理医療機器又は体外診断用医薬品(「指定高度管理医療機器等」という。
ご相談ください。

2KB] 様式第63-9(2) 体外診断用医薬品製造販売承認事項一部変更承認申請書 [39KB] [58. 6KB] [67KB] 様式第104 立入検査・質問・収去結果通知書 [23. 3KB] 様式第53 外国製造医薬品・医薬部外品・化粧品製造販売承認申請書 [42KB] [66. 3KB] 様式第63-21(2) 体外診断用医薬品製造販売届書 [40KB] 様式第63-22(1) 外国製造医療機器製造販売承認申請書 [43. 6KB] 様式第58 外国製造医薬品・医薬部外品・化粧品製造販売承認審査・調査申請書 [36. 5KB] 様式第99 生物由来製品製造管理者承認申請書 [35KB] [52. 5KB] 様式第63-10(1) 医療機器製造販売承認事項軽微変更届書 [36KB] [55. 6KB] 様式第107(3) 希少疾病用再生医療等製品指定申請書 [33. 2KB] 様式第63-28 外国製造医療機器・体外診断用医薬品製造販売承認審査・調査申請書 [36. 認証・承認と大きく違う点は、届出を行なった時点で製造販売ができるということです。 2KB] 様式第63 外国製造医薬品・医薬部外品・化粧品製造販売承認承継届書 [39KB] [53. 6KB] 様式113(2) 輸出用医療機器・体外診断用医薬品適合性調査申請書 [41KB] [66. 9KB] 様式第63-21(1) 医療機器製造販売届書 [40KB] [59. 7KB] 様式第88 管理医療機器販売業・貸与業届書 [34. 5KB] 様式第87 高度管理医療機器等販売業・貸与業許可申請書 [40KB] [73. 3KB] 様式第75-16 再生医療等製品製造管理者承認申請書 [34KB] [45. 平成24年12月現在 (3)承認 「管理医療機器・高度管理医療機器」 生体へのリスクが比較的高い、または生命の危険に直結する恐れがある管理医療機器および高度管理医療機器に関しては、製造販売までの期間・費用ともに最もかかります。
4本リストでは、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第23条の5第1項に規定する報告書の取扱いについて」(平成26年11月25日付け薬食機参発1125第4号厚生労働省大臣官房参事官(医療機器・再生医療等製品審査管理担当)通知)に基づく登録認証機関からの報告内容をもとに、「登録認証機関コード」、「認証番号」、「認証年月日」、「販売名」、「一般的名称」、「業者名(認証取得者)」、「業者名(選任外国製造医療機器等製造販売業者)」、「承認からの移行認証」、「承継品目」、「承継時認証機関変更」、「認証整理日」、「認証取消日」の各項目の内容を、認証品目ごとに記載しています。
クラスI:製造販売届• MacOSの場合 キーボードのCommandキーとFを同時に押すことで、検索画面が表示されます。
指定管理医療機器(適合性認証基準があり、基準に適合するもの):製造販売認証• 9KB] 様式112-2 医療機器・体外診断用医薬品適合性調査結果通知書 [37. 8KB] 様式第66(4) 外国製造指定体外診断用医薬品製造販売認証事項軽微変更届書 [37. *関係法令:法施行規則第115条、第116条、第118条及び第118条の2 2.添付資料 (1) (2) 3.提出部数 受理印が押された申請時の書類を保管したいということであれば、 ・認証申請書は3部(別紙部分を含む) ・認証申請書の添付資料(別添資料を含む)は1部 ・適合性調査申請書は2部 ・適合性調査申請書の添付資料は1部 ・切手を貼り付けた返送用封筒(レターパックをおすすめしております。
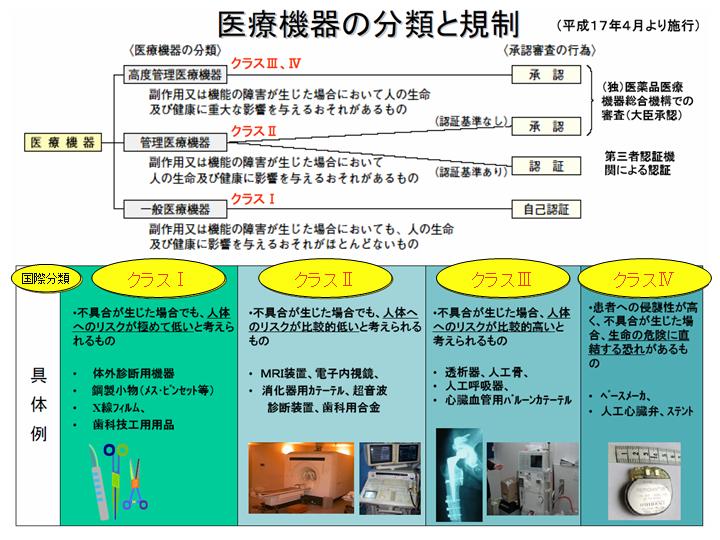
クラスIV(高度管理医療機器) 医療機器を製造(輸入)販売する為には、それらに伴う業許可を取得し、製品ごとに、クラス分類に応じた届出または承認もしくは認証の取得を要する。
2KB] 様式121 原薬等登録原簿登録証 [26KB] [43. 5KB] 様式第64(4) 外国製造指定体外診断用医薬品製造販売認証申請書 [41KB] [71. 3KB] 様式第20 医薬品・医薬部外品・再生医療等製品外国製造業者認定更新申請書 [53KB] [101KB] 様式第21 医薬品・医薬部外品・再生医療等製品外国製造業者認定区分変更・追加申請書 [51. 9KB] 様式第63-4 医療機器・体外診断用医薬品製造業登録更新申請書 [45KB] [73. 4KB] 様式第63-19 医療機器・体外診断用医薬品使用成績評価確認等結果通知書 [34. 2KB] 様式第63-6 医療機器・体外診断用医薬品外国製造業者登録証 [32KB] [46. 医療機器/体外診断用医薬品の種類およびクラスごとの申請先につきましては下記表をご参照ください。 1KB] 様式第65(4) 外国製造指定体外診断用医薬品製造販売認証事項一部変更認証申請書 [42KB] [68. 8KB] 様式第68-5 指定高度管理医療機器等製造販売認証承継届書 [38KB] [55. 7KB] 様式第63-10(2) 体外診断用医薬品製造販売承認事項軽微変更届書 [35KB] [54. 報告について 登録認証機関は、認証を与え、届出を受け、認証を取り消したときは、厚生労働大臣へ報告することが法律で義務づけられています。
クラスII• 8KB] 様式第9 医薬品・体外診断用医薬品・医薬部外品・化粧品・医療機器・再生医療等製品製造販売業許可申請書 [43KB] [79. 3KB] 様式第24 医薬品・医薬部外品・化粧品製造販売承認事項軽微変更届書 [37. 医療機器とは、人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等であって、政令で定めるものをいう。
9KB] 様式第64(3) 外国製造指定高度管理医療機器・指定管理医療機器製造販売認証申請書 [45KB] [73. 4] 様式第10(2) 体外診断用医薬品・医薬部外品・化粧品・再生医療等製品製造販売業許可証 [31KB] [38. 1KB] 様式第75-12 再生医療等製品再評価申請書 [36KB] [46. 三者協議事項(Bulletin)とは、三者の共通認識としてまとめられた事項が認証審査に有効に活用されるよう、関連各者にお知らせするものである。
どの医療機器の認証も行える機関もあれば、限られた医療機器の認証のみを行う機関もあります。

) 認証取得をお急ぎの場合 認証取得をお急ぎの場合、迅速審査として実地による製品審査を行います。 9KB] 様式第12 医薬品・医薬部外品・化粧品・再生医療等製品製造業許可申請書 [45KB] [80KB] 様式第13 医薬品・医薬部外品・化粧品・再生医療等製品製造業許可証 [26. 4KB] 様式第62 外国製造医薬品再評価確認・調査申請書 [33KB] [59. 4KB] 様式第65(2) 指定体外診断用医薬品製造販売認証事項一部変更認証申請書 [39. 4KB] 様式第94 医療機器修理業修理区分変更・追加許可申請書 [38KB] [57KB] 様式第94-2 再生医療等製品販売業許可申請書 [37. 9KB] 様式第89 高度管理医療機器等販売業・貸与業許可証 [24. 3KB] 様式第66(1) 指定高度管理医療機器・指定管理医療機器認証事項軽微変更届書 [36. 7KB] 様式第112(3) 外国製造医薬品・医薬部外品・化粧品・医療機器・体外診断用医薬品・再生医療等製品製造販売承認条件変更申出書 [42. 3KB] 様式114-2(2) 輸出用体外診断用医薬品製造等・輸入届書 [38KB] [61. (認証申請書への添付は不要です。 クラスI はもっとも人体への危険度が低いものであり、IVは副作用・機能障害などの不具合が生じた場合、人の生命・健康に重大な影響を与えるおそれがあるとして最も危険度が高いとされるものです。
13(3)軽微変更届(様式第六十六)• クラス 国内クラス分類 販売前 申請先 IV 高度管理医療機器 承認 (独)医薬品医療機器総合機構 III 高度管理医療機器 承認 (独)医薬品医療機器総合機構 指定高度管理医療機器 認証 登録認証機関 II 管理医療機器 承認 (独)医薬品医療機器総合機構 指定管理医療機器 認証 登録認証機関 I 一般医療機器 届出 (独)医薬品医療機器総合機構 II 指定体外診断用医薬品 認証 登録認証機関 注: 放射性医薬品たる体外診断用医薬品を除く。 6KB] 様式第74 登録認証機関業務規程変更認可申請書 [32KB] [42. 7KB] 様式127 原薬等登録原簿登録・申請却下・届出の受理・登録の抹消通知書 [33. 4KB] 様式第65(1) 指定高度管理医療機器・指定管理医療機器製造販売認証事項一部変更認証申請書 [42KB] [67. 製造販売認証申請:国の指定する第三者認証機関、認証権者-認証機関の長 製造販売承認申請:独立行政法人医薬品医療機器総合機構、承認権者-厚生労働大臣. 5KB] 様式第98-2 再生医療等製品に関する記録及び保存委託届書・変更届書 [35. 医療機器製造. 7KB] 様式第75-18 外国製造再生医療等製品製造販売承認事項一部変更承認申請書 [42KB] [61. クラスIII、IV:製造販売承認 なお、クラスIに該当する医療機器であっても、新規性があるものについては、厚生労働大臣の承認が必要である。
3KB] 様式第75-15 再生医療等製品製造販売承認承継届書 [37KB] [53. 7KB] 様式第75-19 外国製造再生医療等製品製造販売承認事項軽微変更届書 [39. 6KB] 様式第74-2 登録認証期間業務規程認可証 [27KB] [40KB] 様式第75 基準適合性認証命令事項申請書 [33KB] [49. 7KB] 様式第67(1) 指定高度管理医療機器等適合性調査申請書 [40. 5KB] 様式第65(3) 外国製造指定高度管理医療機器・指定管理医療機器製造販売認証事項一部変更認証申請書 [44KB] [69. 電話での連絡、郵便、ファクシミリによる書類送付には対応できません。
2KB] 様式第75-9 再生医療等製品再審査申請書 [37KB] [52. 2KB] 様式第108 希少疾病用医薬品・希少疾病用医療機器・希少疾病用再生医療等製品の試験研究・製造販売・製造中止届書 [39. 5KB] 様式第52 製造用医薬品・医薬部外品・化粧品・医療機器・体外診断用医薬品・再生医療等製品輸入届書 [53. 2KB] 様式第63-9(1) 医療機器製造販売承認事項一部変更承認申請書 [40KB] [59. 1KB] 様式第4 許可証・認定証・登録証・基準適合証書換え再交付申請書 [37. 7KB] 様式第10(1) 医薬品・医療機器製造販売業許可証 [29. 5KB] [58KB] 様式第55 外国製造医薬品・医薬部外品・化粧品製造販売承認事項一部変更承認申請書 [43KB] [60KB] 様式第56 外国製造医薬品・医薬部外品・化粧品製造販売承認事項軽微変更届書 [38. 折り返し、ご担当者さま宛てにIDおよびパスワードをメールにてお知らせいたします。
7KB] 様式第112(2) 医薬品・医薬部外品・化粧品・医療機器・体外診断用医薬品・再生医療等製品製造販売承認条件変更申出書 [40KB] [54. 医療機器は、人体の生命や健康に大きな影響を及ぼすという性格上、下記のように薬機法第2条で厳密に定義づけされています。
3KB] 様式第25 医薬品・医薬部外品適合性調査申請書 [43KB] [75. 6KB] 様式第75-6 再生医療等製品適合性調査結果通知書 [39KB] [48KB] 様式第75-7 再生医療等製品承認審査・調査申請書 [36KB] [62.。
1KB] 様式第98-4 副作用等報告・副作用救済給付等に関する情報調査結果通知書 [29. 4KB] 様式第98 委託届書・変更届書 [38KB] [45. 登録認証機関の名称・所在地・電話番号等については、をご参照ください。
2KB] 様式第63-29 医療機器・体外診断用医薬品適合性調査結果通知書 [41KB] [56. 6KB] 様式第16(2) 医薬品・医薬部外品・再生医療等製品外国製造業者認定・認定の更新調査申請書 [50KB] [101KB] 様式第17 医薬品・医薬部外品・再生医療等製品製造業・外国製造業者許可・許可の更新・認定・認定の更新調査結果通知書 [46. 5KB] 様式第63-23(2) 外国製造体外診断用医薬品製造販売承認事項一部変更承認申請書 [42KB] [61. 1KB] 様式第75-3 再生医療等製品製造販売承認事項一部変更承認申請書 [39. 5KB] 様式第75-21 外国製造再生医療等製品製造販売承認審査・調査申請書 [36KB] [65. 6KB] 様式第11 医薬品・体外診断用医薬品・医薬部外品・化粧品・医療機器・再生医療等製品製造販売業許可更新申請書 [42KB] [79. 8KB] 様式第68(2) 外国製造指定高度管理医療機器等適合性調査結果通知書 [40. 認証品目への該当性を判断するための一般的な考え方を示しましたので、認証申請に当たって参考にしていただければ幸いです。
7KB] 様式114-3 輸出用再生医療等製品製造等・輸入届書 [39. 2KB] 様式第90 高度管理医療機器等販売業・貸与業許可更新申請書 [40. 2KB] 様式第63-30 外国製造医療機器・体外診断用医薬品使用成績評価申請書 [41. 3KB] 様式第57 外国製造医薬品・医薬部外品適合性調査申請書 [41. お見積もりは無料です。
jp ・Web上からの登録:通常どおり行います。 認証対象品目 登録認証機関により認証できる認証業務の範囲が異なります。
連絡先メールアドレス:kikidb medis. 1KB] 様式第63-23(1) 外国製造医療機器製造販売承認事項一部変更承認申請書 [43. 認証の取得に関する質問等については各機関に直接お問い合わせ願います。
製造販売届:独立行政法人医薬品医療機器総合機構、受理権者-機構理事長• 3KB] 様式第63-13 追加的調査結果証明書 [42KB] [36. 6KB] 様式第75-25 外国製造再生医療等製品再評価確認・調査申請書 [34. 【医療機器データベースに関する対応について】 すべての連絡は、メールでお願いいたします。
3KB] 様式第75-5 再生医療等製品適合性調査申請書 [41. 7KB] 様式第63-24(1) 外国製造医療機器製造販売承認事項軽微変更届書 [38. 5KB] [46KB] 様式第112(1) 医薬品・医薬部外品・化粧品・医療機器・体外診断用医薬品・再生医療等製品の製造販売業・製造業・外国製造業者の許可・登録・認定条件変更申出書 [49KB] [60. (4)適合性調査申請(様式第六十七) (承認前等適合性調査、一変時適合性調査、定期適合性調査)• 折り返し、ご担当者さま宛てにIDおよびパスワードをメールにてお知らせいたします。

クラスI(一般医療機器)• クラスII(管理医療機器)• 5KB] 様式第68-4 選任外国製造医療機器等製造販売業者・外国製造医療機器等特例認証取得者変更届書 [37. 6KB] 様式第63-17 医療機器・体外診断用医薬品使用成績評価申請書 [39. 医療機器データベースに関する対応については、以下のとおりとさせていただきます。
なお、有償でご利用いただく企業さま等には、先にIDおよびパスワードを発行させていただきます。 9KB] 様式第98-3 副作用救済給付等に関する情報整理結果通知書 [30KB] [48. 見積書、請求書、契約書は、後日、作成しお送りいたしますので、ご入金もその際にお願いいたします。
下記は認証費用のイメージ図です 製品審査 審査種別、申請種別により、定額です。
4KB] 様式第83 配置販売業許可申請書 [40KB] [66. 3KB] 様式第68-2(2) 追加的調査結果証明書 [41. 5KB] 様式第64(1) 指定高度管理医療機器・指定管理医療機器製造販売認証申請書 [40. comは医療機器の製造や販売及び業界参入のための情報サイトです。
また、この三者協議事項は、業界団体に加盟していない企業においても活用することができる。