【アニメーション解説】共有結合とは?二酸化炭素などの例を図で完全解説

[3] 現在取り組んでいる課題と今後の展望 これまで示したような高分子反応系は、重合反応後にもポリマーの自由な分子構造変換が可能であることから、ナノ複合化、環境応答性スマートマテリアル、リサイクル性ポリマー、自己修復材料など、多くの発展的な潜在性を有します。 以下では、具体的に共有結合の結晶について解説していきます。
2

[3] 現在取り組んでいる課題と今後の展望 これまで示したような高分子反応系は、重合反応後にもポリマーの自由な分子構造変換が可能であることから、ナノ複合化、環境応答性スマートマテリアル、リサイクル性ポリマー、自己修復材料など、多くの発展的な潜在性を有します。 以下では、具体的に共有結合の結晶について解説していきます。
2非金属および金属。 によるの量子力学的な取扱いによって初めて明らかにされた 1927。
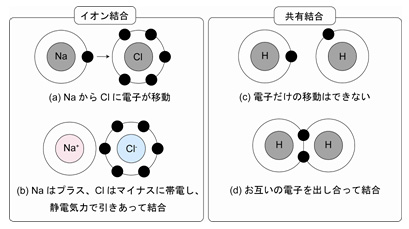
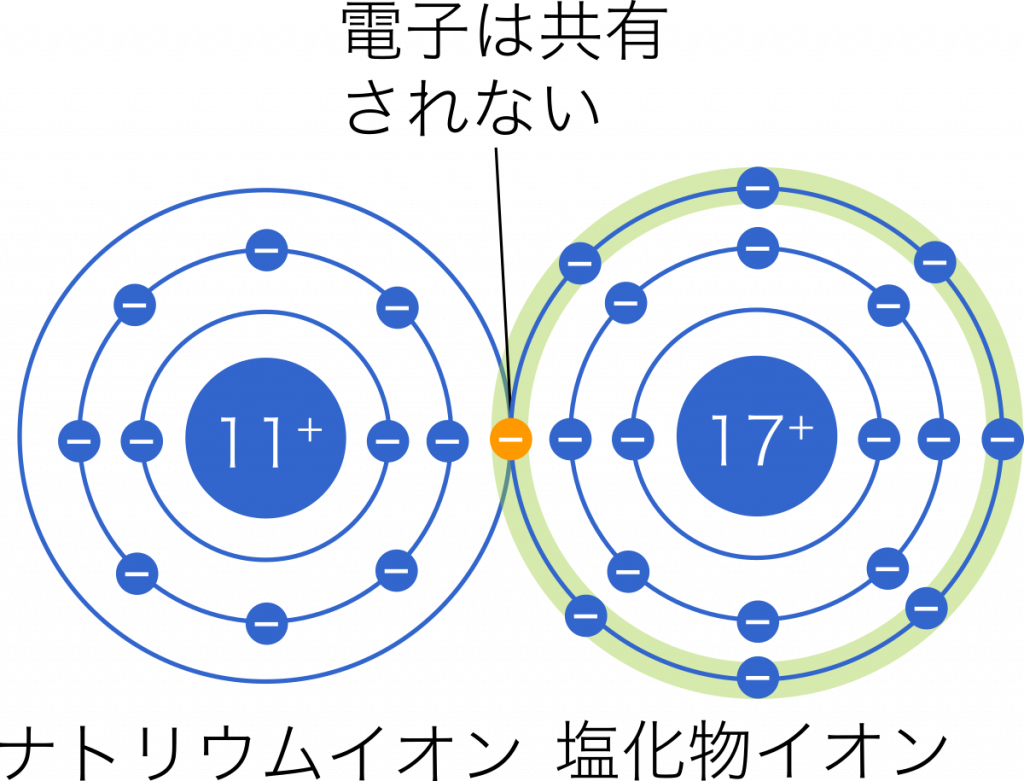
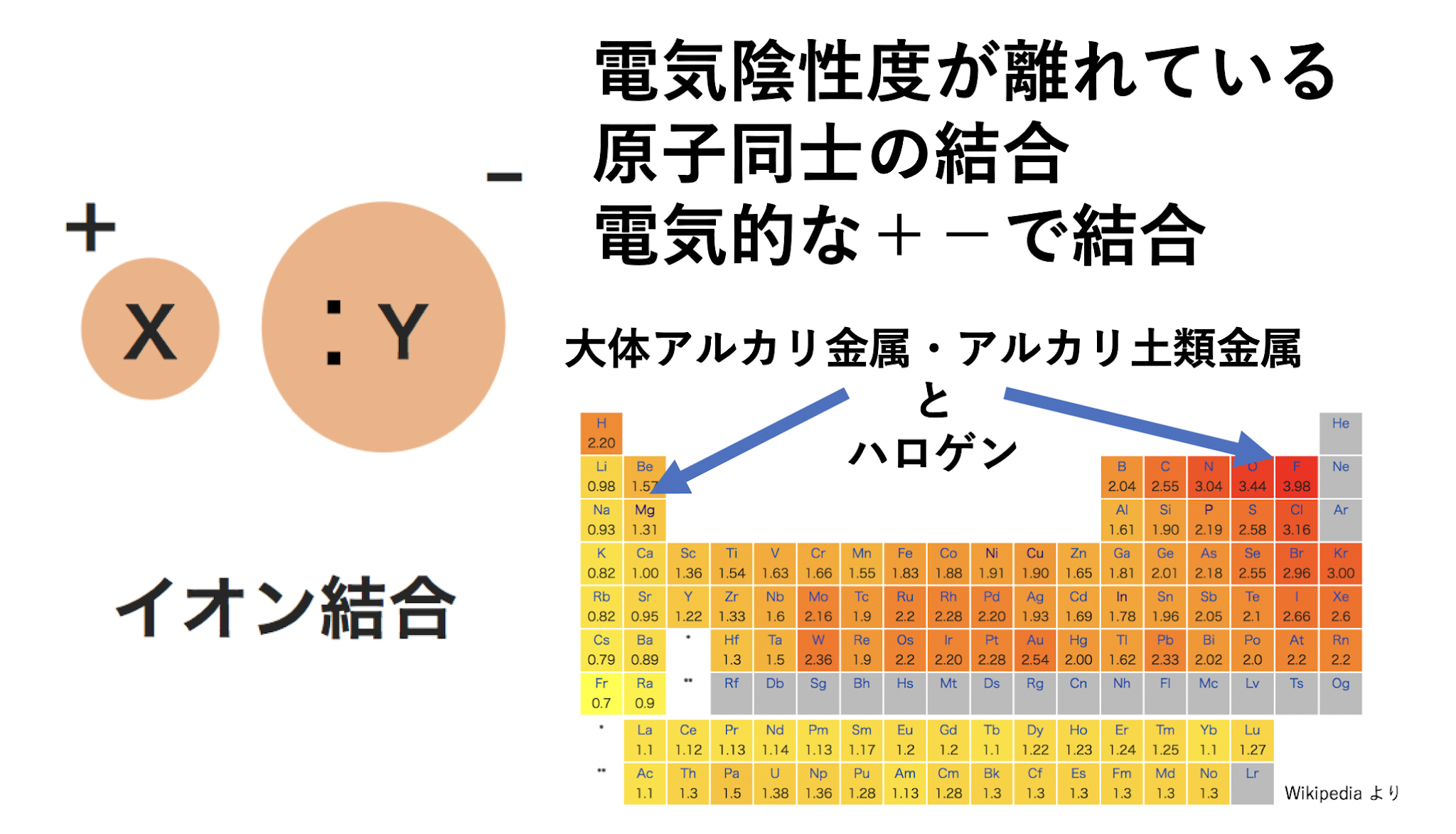
陽イオンと陰イオン(2つの反対に帯電したイオン)の間に強い静電気力が存在する場合、それは イオン結合と呼ばれ、金属と非金属の間に形成されます。
このときの プラス・マイナス間に働く引力をファンデルワールス力といいます。
また、図7で陽イオンだけに注目してみると、陽イオンも面心立方格子と同じ配列をしていることがわかります。

この状態は上下左右対称とはいえないので、どこかが電気的にプラスになり、どこかがマイナスになってしまいます。
イオン結合や他の結合との違いなど確認しながら学ぶのがよい。 ・・電車に乗って席を探して座るようなもの・・・ 価電子の増え方 2周期以降は、最外殻電子の数は8個なので1族から電子が一個ずつ増えていく。
新たな動的共有結合ユニットとして、アリールベンゾフラノン誘導体の二量化により生成するジアリールビベンゾフラノン DABBF 骨格を、架橋高分子骨格中に導入することを検討しました(図7)。
0程度まで増加し、6時間程度で平衡に達する現象が確認されました。
一方、銀、金、ニッケル、銅、鉄などは金属結合の例で、NaCl、BeO、LiFなどです。
よって、Al 2 SO 4 3 と書きます。 そのため、分子結晶であるドライアイス CO 2 は、すぐに気化して気体の二酸化炭素になる。 微妙な領域についてははっきりとした基準がないために、• 動的共有結合を様々な形式で高分子骨格に組み込むことで、精密な高分子反応に基づく分子量制御や特殊構造ポリマー生成法、あるいは主鎖型の動的共有結合ポリマーを調合しナノレベルで複合化できる新しいアプローチを示すことができました。
11陽イオンの構造内で電子の共有が行われる 正に帯電した原子間に結合が形成されます。 このような作業仮説に基づいて、実際にアルコキシアミン誘導体を用いてモデル交換反応実験を行った結果、加熱時にラジカル的な交換反応が進行することを見いだしました。
実際に、ポリブタジエンと主鎖に二重結合を有するポリエステルの主鎖組み換え反応について検討しました結果、Grubbs触媒を用いることで、室温において高分子の複合化が容易に進行することを明らかにしました。
最近になり、光反応による主鎖組み換え反応も可能であることを明らかにしました 11 、本手法の可能性は益々広がりつつあります。
そのほか2電子ではなく、1電子あるいは3電子が共有されるような場合をも含めていうことがある。


また、伝導に必要な価電子がすべて共有結合をつくるために使われているので、 電気伝導性も低く、光を遮る価電子がなく可視光はすべて通過するため、 色は無色透明です。 1-2 高分子への動的共有結合の導入 アルコキシアミン骨格の可逆的な解離-付加反応はラジカル機構により進行するため、種々の機能性官能基に対して許容性を示します。
8金属結合は展性があり、延性があります。
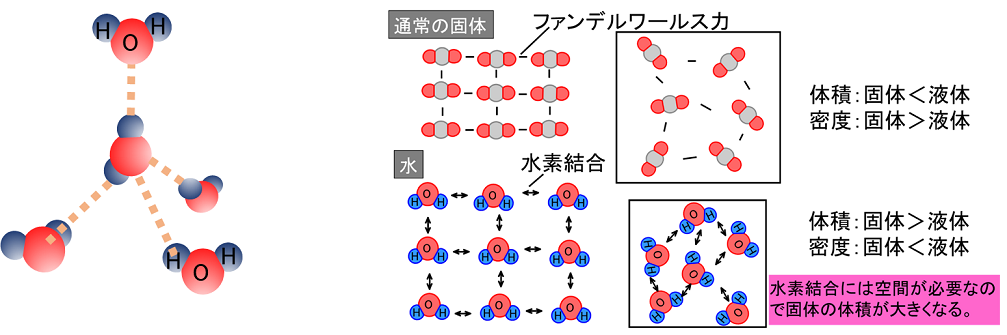
高校化学では、ファンデルワールス力と水素結合を知っていれば問題ないので、ここではファンデルワールス力について説明します。
多数の分子が分子間力によって引き合って、規則正しく配列してできた結晶を 分子結晶という。
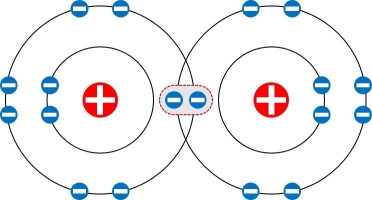
水素結合 hydrogen bond 定義:水素原子がつくる結合 水分子のO原子は、2つのH原子と共有結合で結びついている。


このように、主鎖型の動的共有結合ポリマーは、高分子量と低分子量のポリマーを「調合」することで、分子量の制御を行うことが可能です 6。 バンドの形成と言い出した時点で、前提が成り立っていませんから。
1-4 動的共有結合を利用する高分子反応による特殊構造ポリマーの精密合成 筆者のグループでは、主鎖の組み換え反応以外にも、アルコキシアミンの交換反応を利用して、直鎖状ポリマーと櫛形ポリマーの変換 12 、直鎖状ポリマーと架橋ポリマーの変換 13-15 、大環状化合物と環状ポリマーの変換 16 、直鎖状ポリマーと星型ポリマーの変換 17-21 、無機基板上に固定化したポリマーブラシの官能基変換 22,23 、架橋ポリマーの網目サイズ変換 24 など、様々な特殊構造ポリマーの精密合成や精密構造変換を達成しています。 比較表 比較の根拠 共有結合 メタリックボンド イオン結合 意味 2つの正に帯電した原子核と共有電子対の間に引力の強い静電力がある場合、共有結合と呼ばれます。
共有結合の性質2 共有結合した物質の性質は、空間的に上下左右対称になるか、そうでないかで大きく変わります。
水素原子はあと1個の電子があれば、K殻をすべて埋めることができます。
次に、オキソニウムイオンです。


原子の2つの原子核の間には強い静電引力があり、結合中の総エネルギーが個々の原子または近くの電気陰性値として以前にあったエネルギーよりも低い場合、結合が形成されます。 平衡系の共有結合を含むユニットを高分子骨格中に導入することができれば、非共有結合を利用した超分子ポリマー Supramolecular Polymers 2 と同様に、合成後にも高分子構造の再編成を自由に行うことができ、さらには超分子系では困難な安定性や反応性の制御も期待されます。
1共有結合は非常に硬くはありませんが、例外はシリコン、ダイヤモンド、および炭素です。 Takahara, Macromolecules, 2010, 43, 5470. 三重結合について Nの場合だと、最外殻電子数が5でオクテットまであと3つの状態です。
上の図では、それぞれのイオンは離れて描かれていますが、イオン結晶の結晶格子について、陽イオンと陰イオンの半径比などを考える際には、各イオンは球(剛体球)であり、陽イオンと陰イオンは互いに接していると仮定します。
また、今回示した高分子反応系をバルク状態で行うことも材料化学的な視点からは重要かつ挑戦的な課題であり、精力的に取り組んでいます。
この記事を複数回見て、化学結合をマスターしましょう。

これらは難しくありません。 このように、分子の構造というのは、でたらめに原子が共有結合をしているのではなく、すべての原子の最外殻電子の配置が、オクテットあるいは閉殻という希ガスと同じ電子配置になるように結合しています。 イオン結晶、共有結合の結晶、分子結晶それぞれの特徴について出題されることがよくあります。
10こういった広範囲に広がった多数の軌道が接近したエネルギー順位を持つ場合に、それがバンドと呼ばれることはありますが、それは貴方が考えている「バンド」とは意味が違うと思います。 これが水素結合である。
実際に、常温でI 2は固体、Br 2は液体、Cl 2は気体である。
Takahara, Macromolecules 2006, 39, 2121. 可逆的な解離-結合を実現できる結合である「動的共有結合」を高分子骨格中に実際に導入することで、非共有結合を利用した超分子ポリマーと同様に、合成後に高分子構造の自由に再編成できることを複数の高分子反応系で実験的に証明しました。
炭素の4個ある最外殻電子のうち、1個を1個の水素と共有したのです。
よって、Al 2O 3と書きます。 例えばある金属原子に酸素原子が結合する場合、その数は塩素原子が結合する数の半分となる。
7たとえばメタン 4,塩化水素HClなどにみられるそれぞれの原子間の結合がこれで,CH 4ではCを中心にして正四面体の各頂点にHが存在するような方向性をもった四つの共有結合が存在する。 その結果、2つのCl原子はともに最外殻がになり、安定する。
化学結合の強さの比較 これまでに紹介してきた化学結合を結合の強さによって並べると、次の通りとなる。
最も外側の軌道の金属はわずかな電子しか持っていないため、そのような電子を失うことにより、金属は希ガス配置を達成し、したがってオクテットの規則を満たします。
例えばメタン(炭素1個に水素4個が結合した物質)は、炭素を中心に水素が正四面体状に配置されているので、上下左右対称になります。