医療機器の管理

などしてくださる(/)。 (登録の基準等)• (イ)医療機器の第1種製造販売業の総括製造販売責任者の要件を満たす者。


などしてくださる(/)。 (登録の基準等)• (イ)医療機器の第1種製造販売業の総括製造販売責任者の要件を満たす者。
)が次に掲げる要件のすべてに適合しているときは、第二十三条の二の二十三第一項の登録をしなければならない。 3第一項の登録は、三年を下らない政令で定める期間ごとにその更新を受けなければ、その期間の経過によつて、その効力を失う。
)に支配されているものとして次のいずれかに該当するものでないこと。
*申請者は第3種医療機器製造販売業許可を取得している必要があります。
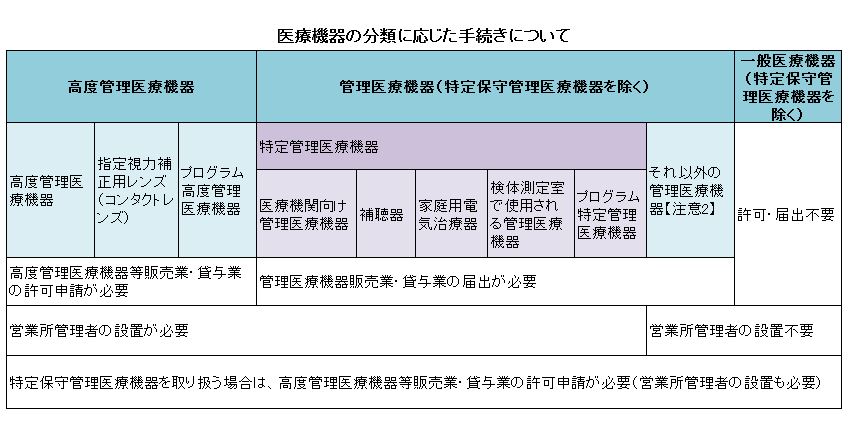
不具合が生じても人体へのリスクが比較的少ない)の三つに分類され、それぞれ承認や販売に関する規定が設けられた。

) 2 特定管理医療機器のうち補聴器のみを販売等する販売業者等(「補聴器」) 1 規則第175条第1項第1号前段該当者 (特定管理医療機器の販売等に関する業務(特定管理医療機器のうち家庭用電気治療器及びプログラム特定管理医療機器のみを販売等する業務を除く。 ただし、平成26年11月に施行された医薬品医療機器等法においては、高度管理医療機器のうち「認証基準」が定められた医療機器等についても、この基準に適合する医療機器等については、その製造販売に当たって、登録認証機関の認証を受けなければならないこととされています。 - 医療器具の使い回しによる院内感染で死亡した女性 外部リンク [ ]•。
132019年5月時点で、2,274品目の認証基準が定められています。
クラス分類の基本的な考え方 1. )若しくは、当該店舗に係る適格者(薬事法施行令第51条に定める基準に該当するか、又は薬事法第28条第2項に規定する試験に合格したことによって当該店舗においてその者が属する法人に薬種商販売業の許可が与えられた者。
クラスIII(高度管理医療機器)• (ただし、この場合、平成17年4月1日以降、速やかに、営業所の管理者の届出を行う必要があります。
薬事法第40条の2第1項に規定する医療機器の修理業の許 可を受けた者(特定保守管理医療機器の修理業区分許可を受けた修理業者)に委託できます。


販売従事登録証 (みなし合格登録販者に限る)• 当該医療機器の安全性と効能を担保するためのGCP遵守の臨床試験データを添付しなくてはならない。
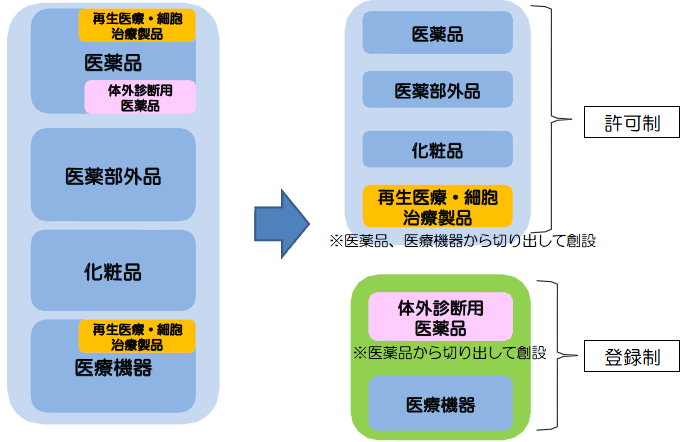
2省令第169号は、QMS省令(医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令)ともいわれ、:2003を、一部の用語・内容を医薬品医療機器等法に整合させた形で修正した基準である。
医療機器クラス分類表 各医療機器はリスクに応じてクラス1から4まで分類されており、製造や販売等においてはリスクに応じた規制が行われます 別添の「クラス分類表」により、個々の医療機器毎のクラス分類の別、特定保守管理医療機器指定の有無をお知らせしますので、ご利用ください。
添付書類• 所管と窓口 [ ] 日本においては、(医薬品医療機器等法)に医療機器の定義、規制、取扱いが定められている。
4前項の登録の更新については、第二項の規定を準用する。
詳しくはをご覧ください。 修理を行う作業所ごとに取得する必要がある。
(2)特定管理医療機器のうち補聴器のみを販売等する販売業者• なお、非該当である場合で、管理者になろうとする者が免除要件を満たさない場合は、医薬品医療機器等法規則第175条第1項第1号に規定する講習会の受講 特定管理医療機器関連 が必要となり、特定保守管理医療機器に該当する場合は、医薬品医療機器等法施行規則第162条第1項第1号に規定する講習会の受講が必要となりますので、よく確認をしてください。
イ 登録申請者が株式会社である場合にあつては、製造販売業者等がその親法人(会社法(平成十七年法律第八十六号)第八百七十九条第一項に規定する親法人をいう。
*製造業者に対してのQMS適合性調査は、PMDA、第三者認証機関、都道府県等によって行われます。
*申請者は第1種医療機器製造販売業許可を取得している必要があります。
医療機器の保守点検は、医療機関の業務であり、自ら適切に実施しなければならないと定められています。
また、第三者登録認証機関に対して、認証申請と併せてQMS適合性調査申請も行い、医療機器製造所(製品の組立製造にかかるすべての製造所(外国製造業者を含む。
20世紀の後半に、やなどのラージME機器が発明され、現代の医療機器の礎が築かれた。
日本の製造販売業者が外国製造医療機器を輸入しようとする場合には、製品の承認・認証取得、届出の前に、当該製品を製造する外国製造業者が外国製造業者認定を取得している必要がある。
四 登録認証機関が行う基準適合性認証の業務の範囲 「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(昭和35年法律第145号)第23条の2の23第1項の規定により基準が定められた高度管理医療機器及び管理医療機器(以下「指定高度管理医療機器等」という。
具体的には下記のとおりである。
例えばは、2003年にを制定し同法によって医療機器(의료기기)を行っている。
三 基準適合性認証を行う事業所の所在地• クラスIII、IV:製造販売承認 なお、クラスIに該当する医療機器であっても、新規性があるものについては、厚生労働大臣の承認が必要である。

048-461-0468 048-461-0133 〒351-0016朝霞市青葉台1-10-5 朝霞市、志木市、和光市、新座市、富士見市、ふじみ野市、三芳町 048-737-2133 048-736-4562 〒344-0038春日部市大沼1-76 春日部市、松伏町 048-925-1551 048-925-1554 〒340-0035草加市西町425-2 草加市、八潮市、三郷市、吉川市 048-541-0249 048-541-5020 〒365-0039鴻巣市東4-5-10 鴻巣市、上尾市、桶川市、北本市、伊奈町 0493-22-0280 0493-22-4251 〒355-0037東松山市若松町2-6-45 東松山市、滑川町、嵐山町、小川町、川島町、吉見町、ときがわ町、東秩父村 049-283-7815 049-284-2268 〒350-0212坂戸市石井2327-1 坂戸市、鶴ヶ島市、毛呂山町、越生町、鳩山町 04-2941-6535 04-2954-6615 〒350-1324狭山市稲荷山2-16-1 所沢市、飯能市、狭山市、入間市、日高市 0480-61-1216 0480-62-2936 〒347-0031加須市南町515 行田市、加須市、羽生市 0480-42-1101 0480-43-5158 〒340-0115幸手市中1-16-4 久喜市、蓮田市、幸手市、白岡市、宮代町、杉戸町 048-523-2811 048-523-4486 〒360-0031熊谷市末広3-9-1 熊谷市、深谷市、寄居町 0495-22-6481 0495-22-6484 〒367-0047本庄市前原1-8-12 本庄市、美里町、神川町、上里町 0494-22-3824 0494-22-2798 〒368-0025秩父市桜木町8-18 秩父市、横瀬町、皆野町、長瀞町、小鹿野町 保健所設置市 048-840-2235 048-840-2228 〒338-0013さいたま市中央区鈴谷7-5-12 さいたま市 049-227-5101 049-224-2261 〒350-1104川越市小ヶ谷817-1 川越市 048-266-5557 048-423-8852 〒333-0842川口市前川1-11-1 川口市 048-973-7532 048-973-7536 〒343-0023越谷市東越谷10-31 越谷市• 後発医療機器 2 承認基準あり・臨床試験データ不要 上記「後発医療機器」であり、さらに当該医療機器は下記事項に該当し、かつ臨床的安全性及び有効性を担保するためのGCP臨床試験データの添付を必要としない。 包装・表示・保管 施設は、に適合していなければならない。 構造設備基準 薬局等構造設備規則 2 厚生労働省令で定める構造設備の基準は、次のとおりである。
4認定制度 [ ] 外国の製造業者(海外製造施設)は、外国製造業者認定を取得することができる。 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和三十五年八月十日法律第百四十五号)• 大抵継続研修のお知らせが届く。
) に係る認証を行おうとする者から前項の申請があつた場合において、必要があると認めるときは、機構に、当該申請が次条第一項各号に適合しているかどうかについて、必要な調査を行わせることができる。
(ア)医師、歯科医師、薬剤師の資格を有する者。
承認若しくは認証申請又は届出時に添付する添付資料に該当す る記載事項がある場合にあたっては、承認、認証又は届出された内容を正確に記載すること。

また、製造工程において外部検査施設に検査を委託する場合は当該検査施設、設計管理が必要な医療機器については設計管理を行う事業所も、省令第169号への適合が求められる。 [平成17年3月18日厚生労働省告示82号参照]. )を販売等の目的で陳列しようとする場合、営業所ごとに届出が必要になりました。
(カ)財団法人医療機器センター及び日本医科器械商工団体連合会が共催で実施した医療機器販売適正事業所認定制度「販売管理者講習」を修了した者。 弊社ではデータを適時更新しております。
」とし、(同法施行令)で類別を定めている。
後発医療機器 1 承認基準なし・臨床試験データ不要 「後発医療機器」とは、既承認医療機器と構造、使用方法、効能、効果及び性能が同一性を有すると認められる医療機器であり、すなわち、既承認医療機器と構造、使用方法、効能、効果及び性能が実質的に同等であるものをいう。
二 登録申請者が第二十三条の二の二十三第一項の規定により基準適合性認証を受けなければならないこととされる指定高度管理医療機器等の製造販売若しくは製造をする者又は外国指定管理医療機器製造等事業者(以下この号において「製造販売業者等」という。