塩化水素(HCl)の発生~なぜNaHSO4?

また,1molの硫酸H 2SO 4が電離すると 2molの水素イオンH +が生じます。 【外部サイト】 大日本除虫菊株式会社 KINCHO ホームページ 味の素株式会社ホームページ 高杉製薬株式会社ホームページ 金属との反応 塩酸は多くの金属を溶解することができます。 生の電荷を持ったイオンが集まっている場合と分子が集まっている場合では融点や沸点にかなりの違いが出てきます。
18
また,1molの硫酸H 2SO 4が電離すると 2molの水素イオンH +が生じます。 【外部サイト】 大日本除虫菊株式会社 KINCHO ホームページ 味の素株式会社ホームページ 高杉製薬株式会社ホームページ 金属との反応 塩酸は多くの金属を溶解することができます。 生の電荷を持ったイオンが集まっている場合と分子が集まっている場合では融点や沸点にかなりの違いが出てきます。
18都度、新しいものが登場するたびに暗記すれば良いですが、まずは代表的な化学式を以下にまとめておきます。
分子でないもの(イオンが集まってできている物質)、分子であっても組成比でしか表現されていないものは組成式です。
�剝���芥�� 嚗� 憛拙��怒�瑯�� �� �剝�怒�瑯�� 嚗� 憛拙����芥��. 覚えておきたい8つの重要な化学反応式 それでは、本題の化学反応式について、具体例をあげて説明していきます。
458890• 自然には活動などで発生する。
強酸 塩化水素HCl,臭化水素HBr,ヨウ化水素HI,硝酸HNO 3,硫酸H 2SO 4 (ハロゲン化水素のうち,フッ化水素HFだけは弱酸) 強塩基 アルカリ金属元素の水酸化物,アルカリ土類金属元素の水酸化物 *よく出てくる強塩基は,次の4つ。 分子式は分子であるものについてしか使うことができません。
瘞渡��扎�� H�� 憛拙��押�芥 Cl�� ���芥��芥 Na�� 瘞湧��扎�� OH�� �怒�艾��扎�� K�� 蝖恍�扎�� SO�聆� �郎��撘��詻��具�颯 鞈芷� g 隞乩��桀�憿���敹��桐��啜�����艾�����摮血�敹��券��靽� �怒�瑯�a�荔�瘞寒2O�典�敹��行偌�詨��怒�瑯�a OH 2�冽偌蝝2������ �怒�瑯��10g���嫘瘞氬. 例えば,酢酸CH 3COOHは次のように電離します。
いわゆる周期表に挙げられているものを指します。
01 このとき,まったく電離していない場合のアンモニアの物質量は 1molです。

だからそれ以外のところについては了解事項であるとしています。 一つずつ丁寧に処理するように心がけましょう。 自分で作ることができるようにすることが目標です。
15それに対して、そ溶解熱とは、ある物質1molを多量の溶媒に溶かしたときに発生または吸収する熱と定義されます。 化学式・化学反応式を知るために、まずは、「原子・元素」から説明します。
エタンの化学式は中学生で暗記しておく必要はありませんが、化学反応式を作成する練習のために、経験しておきましょう。
気を付けたいのが,酸に含まれる水素原子がすべて水素イオンH +になるとは限らないということです。
分子とは2つ以上の原子から構成される電荷的に中性な物質を指すのです。


塩化水素を電気分解すると水素と塩素ができる 電気分解について、もう一つ例を挙げてみましょう。 H原子の数について 次に、H原子の数について注目してみると、両辺それぞれ2個ですから一致しています。
マクロな物質は分子性物質でもイオン性物質でも電荷的には中性です。 高校における化学基礎・化学で出てくる酸・塩基では, 強酸・強塩基の方が圧倒的に少ないので, 強酸・強塩基を暗記してしまい,それ以外は弱酸・弱塩基と判断することができます。
沈殿 ちんでんの化学反応式一覧 沈殿とは:溶液の中の微粒子が集積することで、大きくなった集積体が重力に引かれて溶液の底に沈む現象のこと。
そして、それを合わせるために右辺を2倍すると、今度はCu原子の両辺の数が合わないことになります。
この式では、硫酸の右方向への推進力と塩酸の左方向への推進力が、反応が進むにつれて釣り合うようになります。
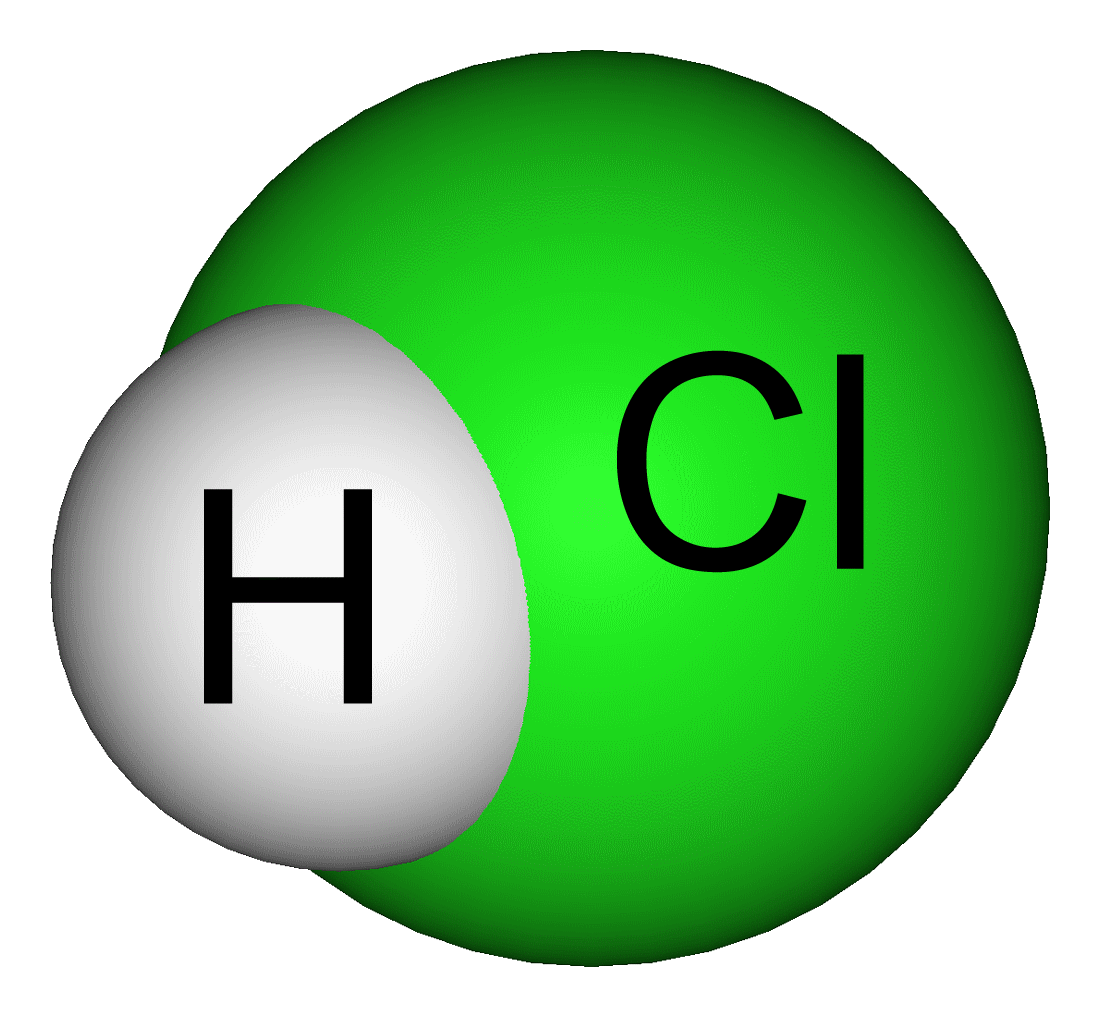
吸入すると生命に危険• 水溶液であるという事を強調する書き方です。 塩酸はであり、と反応してと水を生成する。
中和 ちゅうわの化学反応式一覧 中和とは:酸性の水溶液とアルカリ性の水溶液を混ぜ合わせた時に起きる反応で、お互いの性質を打ち消し合う。
束縛状態が実現しているという意味だろうと思いますが「共有結合で結びついている」という表現の方が分かりやすいです。
反応式の中では食塩水をNaClと書いています。
一方で、実験室レベルでは、塩酸の記事でも取り扱ったように塩化ナトリウムに対して濃硫酸を加えて加熱することで得られます。


matter とかsubstance という言葉は使ってはいません。
従ってこういうことを決めている結合も決まってきます。
これが分子です。
塩酸をHClと表すことがよくありますが,純粋なHClではありません。
右辺と左辺のH原子の数はそれぞれ2個で一致していますが、Oの数について、右辺では1個、左辺では2個という違いがあります。