イオン3

, Butterworth-Heinemann, Oxford, UK, 1997. 1.高度さらし粉に塩酸を加えると塩素が発生します。
5この章の実験のポイントは,次の通りです。 と二がある。
その際、硫酸バリウムが 塩 えんとして生成され沈殿する。
湿った空気中では潮解する。
塩化物イオンCl -ができていたことがわかります。
誰かに持って行ってもらわなければいけません。 1984 Structural Inorganic Chemistry, Oxford: Clarendon Press. NaClなどの塩をつくる素になっているという意味でしょう。
1-10 白濁します。
白色固体でほとんど水に溶けないが、空気酸化により緑色固体のが生成する。
シャープの芯(2)• 2.塩素は室温で黄緑色の気体です。
また塩酸に溶解した塩化銅 I 溶液はガスとも反応し、CuCl C 2H 2 を形成する。 【陰極で起こったこと】 ・ 銅イオンが近づき、電子を得た。
教師用実験台には、次時に使う実験器具『H管』、炭素棒、薬包紙に載せた塩化銅、などが見られます。
無水和物は銅粉を塩素中で熱するか、二水和物を塩化水素気流中で加熱脱水して得られる。
1, Wiley-VCH, Weinheim, Germany, 2002. 塩化物イオン Cl -はもともと塩素原子。

1. 塩素とヨウ素は何族に属している元素ですか? 17族 2.17族元素を総称して何といいますか? 図1:アルミニウムがボロボロになり、その表面に銅が析出している 本時の目標 ・金属原子はイオンのなりやすさ( イオン化傾向)の順によって並べることができることを知る ・ アルミニウムと銅の置換反応実験を行い、アルミニウムの方がイオンになりやすいことを確かめる 準 備 生 徒 教 師• それに、アルミニウムを入れると、イオン化傾向の違いによって置換反応が起こります。
この水溶液には、銅イオンと塩化物イオンがあります。
1-10 1-9で用いた試験管に,蒸留水2mL加え,ゴム栓をしてよく振る。
これらの試薬は有機合成化学において多用されている。
第45章 実験-塩素とヨウ素 08ko-45 この章では,塩素とヨウ素の性質を調べる実験を紹介します。
このように電気分解では、電源装置が電子を動かすため 塩化物イオンCl-が電子を失い、銅イオンが電子を得る という反応が起こります。 塩化銀は沈殿する。
できるだけ吸い込まないようにし,教室の換気に気をつけてください。
つまり、銅イオンは、銅原子が電子を失くしてしまっている状態。
その結果,水溶液は酸性で,漂白作用があります。

教科書• これが 塩素です。 2価の銅イオンCu 2+ができているからですね。 金魚や熱帯魚の飼育用の水は,水道水にチオ硫酸ナトリウムを加えて塩素を除いたものを使う(カルキ抜き)。
5その場合、本時を先に行い、『 3年(2011年度)』を後にすると良いでしょう。
に溶けやすく、、、、などに可溶。
これは塩化銀AgClの沈殿ですね。
銅と塩素の化合物。

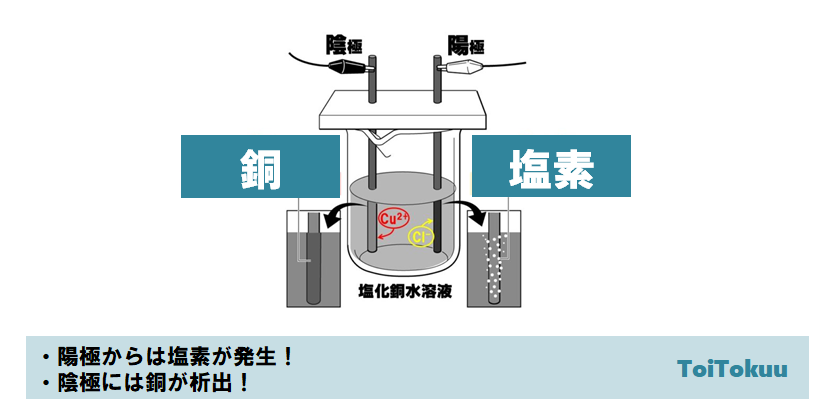
1-5 塩素の入っている1本目の試験管に,湿らせたpH試験紙とヨウ化カリウムデンプン紙を近づけ,それぞれ素早く色の変化をみた後,試験管の中に入れ,ゴム栓をする。 【全体として】 ・水溶液中の塩化銅が塩素の気体と銅の固体へと変化した。
中学生に教える内容やレベルは時代によって変わりますが、最近の私は次のように教えています。 しかし 電流の流れは電子の流れと反対向きでした。
1-8 1-7の水溶液に,硝酸銀水溶液を2~3滴加える。
教科書• 実験では,塩素を発生させてその性質について調べます。
塩化物イオンは電子を失うことで 塩素 原子となります。

よって塩化物イオン Cl -が電子を渡すのがよさそうです。
一例としてが挙げられる。
天然にはナントカイトとして産出する。
それでは考察です。
水溶液からは二、三、四水和物などの結晶が得られる。
図7:ろ紙の上に取った銅 図7では銅がうまく取れず、シャー芯もボロボロになっています。
さらに,うすい赤インクで湿らせたろ紙も試験管の中に入れ,ゴム栓をする。
塩化銅 II 二水和物は非常に歪んだ八面体構造をしており、銅イオンを取り囲む2つの水配位子と4つの塩素配位子は隣の別の銅イオンと非対称的に橋架け構造をとっている。
2-3 水溶液の色はうすい黄色で,ヨウ素は水に溶けにくいことがわかります。